1. Proprietăți de comerț și tehnologice ale aplicațiilor dicloretan
Dicloretan (clorură de etilen) CH2CI-CH2CI - lichid volatil incolor, cu miros specific care amintește de cloroform (p.f. 83,7 ° C;. Cu punct de topire -35,3 ° C; evaporarea termică de 77,3 Kcal / Kg) . Deoarece apă formează un amestec azeotrop (80,5% dicloretan), cu punct de fierbere la 72oS. Dicloroetan lumini cu dificultate, luminoase arde cu flacără, cu franjuri verde, acid clorhidric este eliberată în timpul arderii. Arderea dicloretan poate fi ușor stins cu apă. perechi dicloretan forma amestecuri explozive cu aerul din exteriorul explozivitate 4,8-15,9% (vol.).
Dicloretanul miscibil în toate privințele cu alcooli, benzen, acetonă și mulți alți compuși organici; bine se dizolvă uleiuri, grăsimi, rășini, ceară, cauciuc, alcaloizi, precum și anumite substanțe anorganice, cum ar fi sulf, fosfor galben, iod, și altele.
Dicloretanul este toxic și are un efect narcotic, deci ar trebui să fie atenți atunci când se ocupă cu ei. Dicloretanul inhalarea vaporilor provoacă dureri de cap, iritații ale tractului respirator, tuse, și poate duce la deces. admise vapori maxime de concentrație dicloretan în aerul spațiilor industriale 10 mg / m3.
Dicloretanul este utilizat ca solvent în diferite domenii: pentru extracția grăsimilor pentru curățarea uleiului din ceara, pentru lână degresare și blănuri, precum și produse din metal înainte de placare cu crom sau nichelare, pentru a extrage ceară (ceară montană) din cărbune brun, etc ... el este, de asemenea, un produs intermediar pentru mai multe sinteze industriale. Cantități semnificative de consum dicloretan pentru clorura de vinil.
2. Surse de materii prime: fracția de etilenă de piroliză materii prime de motorină și fracțiuni de cocs de gaz de etilenă.
3. Metode pentru prepararea dicloretan.
Există mai multe modalități de a obține dicloretan de la etilenă:
reacția etilenei cu clor în dicloretan lichid la 20-30 ° C;
trecând etilena prin clor lichid la presiune ridicată și la o temperatură nu mai mare de 0 ° C;
reacția etilenei cu clor, la temperaturi ridicate (120 ° C) peste diferiți catalizatori (CuCI2, FeCl3, SbCI5, cărbune, etc.) ..;
reacția etilenei, acid clorhidric și oxigen peste un catalizator de cupru la 300 ° C:
CH2 = CH2 + 2HCl + → 0,5O2 SN2Sl-SN2Sl + H2O
În industrie, distribuit în principal prima metodă, tehnologic dezvoltat AF Dobryanskiy cu angajații. Ei au demonstrat utilizarea dicloretan pentru a se obține nu numai etilenă pur, ci și ztilensoderzhaschizh exemplu amestecuri fracțiune de etilenă din materia primă motorină de piroliză și fracțiunea de etilenă gaz-cocserie. A doua metodă de realizare a randamentului ridicat al diclorurii de etilenă și necesită un clor lichid foarte concentrat. Mai mult, dicloretan reacția de formare, în acest caz, are loc cu un exces de clor, ceea ce duce la formarea nu numai de dicloretan, dar și alte produse de clorinare etilenă. Dezavantajele altor procese sunt randament scăzut datorită formării de produse de substituție prin dicloretan precum și dificultăți de curățare dicloretan.
fundații 4.Fizikokohimicheskie ale procesului de obținere a dicloretan
Procedeul de obținere a unui complex de reacție dicloretan eterogen. reacția endotermă Irreversible continuă fără utilizarea unui catalizator, la o temperatură scăzută.
Reacția clorului la conexiunea etilenei are loc cu eliberarea de cantități mari de căldură:
CH2 = CH2 + Cl2 → SN2Sl-SN2Sl H = - 48 kcal
La prepararea dicloretan, prin reacția etilenei cu clor în dicloretan lichid, care dizolvă atât gazul, reacția are loc în mod eficient în fază lichidă. Prin acest proces, securitatea este realizat (un amestec de clor gazos și etilena este explozivă) și îmbunătățește condițiile de transfer de căldură din amestecul de reacție la un agent de răcire. căldură Retractare de reacție este facilitată în mare măsură, și elimină complet posibilitatea de supraîncălzire locală. În plus, printre procesul continuă autocatalitic dicloretan și viteza de reacție este considerabil mai mare decât interacțiunea dintre etilenă gazos și clor Când reacția etilenei cu clor, aductul adăugarea de clor la dubla legătură (1,2-dicloretan) și produse de substituție formate - tricloretan, tetracloretan și policloruri mai mari:
CH2 = CH2 + 2Cl2 → SN2Sl-SNSl2 + HCI
CH2 = CH2 + 3Cl2 → SNSl2-SNSl2 + 2HCl etc.
Reacțiile de substituție sunt accelerate odată cu creșterea temperaturii (Fig. 2). Figura arată că la temperaturi de la -30 la -20 ° C, se obține aproape exclusiv dicloretan, în timp ce la + 20 ° C, formată de preferință tricloretan. La creșterea în continuare a temperaturii are loc substituția mai adânc pentru a forma tetracloretan. Limitarea proces are loc prin reacții chimice. Conform Fig. 2, cu o creștere a temperaturii accelerează reacția de substituție, iar temperatura este scăzută - ieșirea dicloretan.
Compoziția produselor obținute variază considerabil în cazul în care mediul de reacție este administrat oxigen liber. În acest caz, formarea de produse de substituție este încetinită sau chiar oprită. Motivul este acela că reacția de substituție a lanțului, în prezența oxigenului este tăiat. Acest lucru simplifică foarte mult producția de tehnologie dicloretan. Prin urmare, adăugarea de oxigen poate fi realizată reacția etilenei cu clor la 20-30 ° C și îndepărtarea căldurii de reacție, fără răcire cu saramură apă rece dorită, la temperaturi sub 0 ° C Acest lucru simplifică procesul de proiectare hardware și scade costul dicloretan.
Mecanismul de inhibare prin reacția de substituție de oxigen unui atom de hidrogen cu un atom de clor nu este clarificat exact. Se crede că rezultă atomii de clor
React cu oxigen, în conformitate cu schema
Cl2 · + O 2 → Cl - O - O ·
Cl - O - O · → Cl ·
ClO · + ClO · → Cl2 + O2 etc.
în care numărul de atomi de clor este redus semnificativ.
5. Aparatură tehnologică de producție sistem de dicloretan
In clorurarea etilenei industrial pentru producerea se efectuează în chlorinator cilindrice verticale etilenă condiții diclorură; Căldura de reacție se îndepărtează cu apă rece care circulă în colaci, iar unitatea de manta. Chlorinator brim umplut dicloretan, barbotat prin care gazele reactante - etilenă și clor. Gazele trebuie golit complet, deoarece clorul umed, parțial hidrolizat, are o acțiune corozivă asupra echipamentului de oțel. Cu uscare suficient de completă a întregului echipament inițial a gazului de reacție și conductele pot fi fabricate din oțel carbon obișnuit.
Etilena este furnizat la separarea instalațiilor de răcire cu adâncime uscat suficient, iar uscarea suplimentară nu este necesară. Din etilena eliberat prin alte mijloace, de exemplu hypersorption, umezeala trebuie îndepărtate prin înghețare sau adsorbanți solide. Utilizarea acidului sulfuric pentru deshidratarea etilenei nu este recomandată datorită prezenței sale în rezinificare apare și sulfonarea hidrocarburilor nesaturate conținute în fracția de etilenă. Clorul este folosit pentru uscare, acid sulfuric concentrat, dar, de obicei, clorul este livrat cu planta cloric deja drenată. Atunci când se lucrează cu gaze de furaje slab drenată necesare osvintsovyvat pereților interiori clorinare, agitator și bobine de răcire.
Schema de producție industrială Procesul de dicloretan este prezentată în Fig. 1. în amestecul gazos care intră în clorinare 1 trebuie să conțină etilenă în exces (5-10% din cantitatea stoichiometrică) necesară pentru legarea completă a clorului. Prezența clorului în gazele de reacție este inacceptabil ca interacțiunea clorului cu hidrocarburi în conducta nerăcit poate crește temperatura de aprindere și hidrocarburilor. Clorul este alimentat în clorurare, diluat
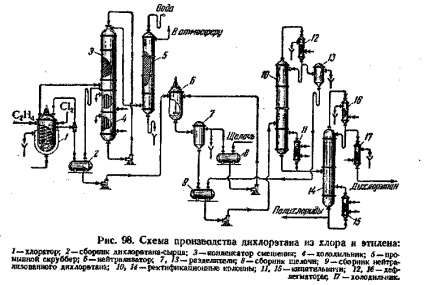
Fig.1. Schema de dicloretan din etilenă și clor:
1 - chlorinator; 2 - o colecție de dicloretan brut; 3 - amestecare condensator; 4 - Holo-dilnik; 5 - spălare de epurare a gazelor; 6 - convertizor; 7, 13 - separatoare; 8 - o colecție de baze; 9 - o colecție de diclorura de etilenă neutralizate; 10, 14 - coloană de rectificare; 11, 15 - cazane; 12, 16 - dephlegmators; 17 - frigider.
aer (8-10% în volum din gazele reactive); acest lucru face posibilă realizarea clorurarea etilenei la 20-30 ° C
Pentru un contact mai bun între gazele și reacționând mai completă dizolvarea ei într-un agitator cu elice clorinare dicloretan instalat. Rezultat dicloretan brut din clorinare curge continuu prin gravitație în colecția 2.
Gazele de eșapament de la clorurare (etilenă nereacționată) impuritățile gazoase prezente în etilena inițial și clor, aer) antrenează o cantitate semnificativă de etilenă vapori de diclorură și o porțiune de acid clorhidric produs ca urmare a reacțiilor de substituție. Prin urmare, din gazele de ardere prin absorbție sau dicloretan recuperat solvent (petrol lampant, etc.), sau prin condensare așa cum se arată în diagrama. Gazele de ardere sunt alimentate la un condensator de amestec ambalat 3 montat peste holodilyshkom 4. În partea superioară a condensatorului de amestec este alimentat din frigider 4, răcită la -20 ° C dicloretan duză de irigare. Gazele care intră în partea inferioară a condensatorului de amestecare, testat duza de jos în sus în contracurent la dicloretan și se răcește la -15 ° C, prin care se condensează aproape toate perechile de dicloretan. dicloretan Condensed amestecat cu dicloretan furnizat pentru irigații, și intră în frigider 4, în cazul în care din nou răcit la -20 ° C, Gazele de evacuare din partea de sus a condensatorului de amestecare, se spală cu apă într-un scruber 5 de acid clorhidric și se lasă în atmosferă.
colectare de dicloroetan brut 2 este pompat în unitatea 6, unde neutralizarea se efectuează cu agitare, dizolvat în acid clorhidric dicloretan hidroxid de sodiu 5-10%. Dicloretan neutralizat este separat în separatorul 7 prin soluția alcalină și se scurge în colector 9 din care este alimentat la uscare și distilare. Uscarea dicloretan produsă în coloana de distilare 10, în partea de jos a cărei temperatură este menținută la 75-85 ° C Din coloana un amestec azeotrop de dicloretan a fost distilat cu apa, condensat în deflegmator 12 și parțial a revenit la reflux coloanei 10. Distilatul este stratificat în separatorul 13; apa este trimis la o instalație de purificare și mai departe în canalizare, și dicloretan este returnat în colecția 9 Din partea inferioară a coloanei 10 curge dicloretan deshidratata intră în continuare în coloana de fracționare 14, unde un tricloretan distilat-dicloretan și separat de policloruri (fund lichid).
6. Calcularea procesului de material de clorurare etilenă echilibru
Date pentru calcul:
Pe baza tabelului. 4.1 [1] definesc randamentele produselor de reacție la o temperatură de 255 K:
Fig. 2. Randamentul produșilor de reacție.
Pe baza Fig. 2, date de ieșire prin produșii de reacție sunt rezumate în Tabelul. 1.
Randamentul produselor de reacție la T = 265K
Gazele de eșapament saturate cu vapori de dicloretan, al căror număr poate fi calculat prin formula [2]:
în care: - numărul de vapori dicloretan, gazele antrenate kg / h;
Gg - cantitatea de gaze au trecut prin dicloretan, kg / h;
φ - coeficientul de saturație (în acest caz, φ = 1 [2]);
presiunea vaporilor de deasupra lichidului (la T = 265 K p = 0,0021 MPa Fig XIV [4]) - p.
MF - greutate moleculară diclorura de etilena;
Mi - greutate moleculară medie a amestecului de gaz;
F - presiunea totală a sistemului, MPa.
Am găsit o greutate moleculară medie a amestecului de gaz:
Dicloretanul antrenării vapori este:
Îndepărtat din lichidul dicloretan reactor, cantitatea de care este:
Consumul de masă de materii prime:
Masa de gaz în condiții normale este egală cu masa molară împărțită la volumul ocupat de un mol, adică În cazul în care - densitatea gazului în condiții normale.
Soldul discrepanță este:
, care este destul de acceptabil.
Transformarea materiei prime.
Agentul principal în materia primă este etilena, astfel încât conversia înainte a etilenei, ca raportul dintre consumul de etilenă (GH-GK) în care GK - cantitatea de etilenă nereacționată cu cantitatea totală de la începutul procesului său gH:
Selectivitatea am constatat ca raportul final al produsului Gp Gc la materia primă a reacționat
Randamentul produsului dorit.
Dacă valoarea produsului Gp țintă (marcă înregistrată), randamentul F pe baza cantității furajelor Gz
Lebedev NN Chimia și tehnologia sintezei organice și petrochimice de bază: Textbook pentru licee. - M. Chemistry, 1988. - 592 p.
General Inginerie Chimică: Textbook. pentru-chimice tehnice. spec. universități. In 2 m. / Ed. prof. I.P.Muhlenova. - M. Executiv. săpt. 1984. - 263 p.
Pavlov, KF Romankiv PG Noskov AA Exemple și probleme pe parcursul proceselor și a dispozitivelor de tehnologie chimică. - L. Chemistry 1987 - 576 p.
Paushkin YM SV Adelson Vishnjakova ETC. tehnologie de sinteză petrochimice, în două părți. Partea I. materia primă de hidrocarburi și produșii de oxidare. M. "Chemistry", 1973. - 448 p.
Sinteza metanolului din monoxid de carbon și hidrogen. Proprietățile tehnologice ale metanol (alcool metilic). Utilizarea de perspective de metanol și de producție. Surse de metanol brut: purificarea gazului de sinteză, de sinteză, metanol brut. Redresoare
Fenol ca agent chimic, utilizarea sa și importanța. Etapele special pentru producerea de fenol. Scurtă descriere a procesului de producție sale prin clorbenzen, cumen, clorinare benzensulfonic, oxidativă a benzenului. Materii prime.
Amoxidarea propilenei și etilenei de clorurare oxidativă. Principalele caracteristici ale proceselor de oxidare într-un catalizator în strat fluidizat. „Air“ și „procese de oxigen“. Tehnologia Recircularea. Cinetica și mecanismul reacțiilor.
Materia primă pentru producerea și metodele pentru prepararea acestuia etanol. Studiu fizico-chimica a proceselor de bază ale producției de alcool etilic. Descrierea schemei tehnologice a procesului de producție, de calcul a parametrilor tehnologici de bază.
proces de oxidare etilenă. Moduri, produse și tipuri de bază de modele de reactoare. Fabricația acizi carboxilici. Metodele de obținere a caprolactamei din materii prime (petrol, gaz și cărbune). Procese dehidroclorurare în sinteza organoclorurate.
Conceptul și esența procesului de clorinare a hidrocarburilor și a altor compuși, istoria descoperirea și dezvoltarea învățăturilor de clorinare. Metodele de preparare a hidrocarburilor clorurate și aplicarea lor în industrie. Caracteristici și primesc ftoroalkanov.
Conceptul de oxirani, natura și caracteristicile specifice ale reacției. oxid de etilenă ca cel mai simplu oxiranul, metode de preparare, folosiți în industrie. Oxidarea peracizi organici halohidrine substituție intramoleculare alchene.
Mărcile comerciale și determinarea proprietăților tehnologiei acetilenă. Sursele de materii prime. Perspectivele pentru utilizarea de materii prime diferite. Metode de pregatire. proces fizico-chimic pentru producerea acetilenei prin piroliza oxidare termică metan.
Conceptul de o hidrocarbură halogenată, izomerii lor și nomenclatura, formula generală și metoda de preparare a numelor. Metodele de preparare a hidrocarburilor halogenate, aplicarea lor în industrie. efect asupra caracterului substanței clor cărbunos.
Ministerul Educației generale și profesionale din România SamGTU Departamentul de Chimie Organică de etilenă și derivații Curs săi în sinteza organică industrială
oxid de etilenă - una dintre cele mai multe sinteze organice mari. Proprietățile fizice și chimice ale substanței. Structura moleculei. Producerea de oxid de etilenă: sinteza prin cloretanol, oxidarea etilenei. Utilizarea oxidului de etilenă.
clorură de vinil, sub formă de derivați de hidrocarburi etilenice un reprezentant monogaloidnyh. Producerea de clorură de vinil, prin Ostrosmyslenskomu, hidroclorurarea acetilenei prin piroliza dicloretan. Producerea de clorură de viniliden, acetat de vinii și etilenă.
Varnavskiy. 10 Aplicație „B“ alchenelor și alkodienov. Alchene. Etilena și omologii săi sunt ușor de oxidat, de exemplu potasiu permarganatom: + O + H O HO - CH formată Totuși etilena - viscos fluid similar cu glicerol utilizat în producția de antigeluri, fibre sintetice litru.
Gazul natural este unul dintre domeniile conține 92% metan, 4% etan. 1% propan, 2% bioxid de carbon și 1% azot (în volum). Care este cantitatea de oxigen necesară pentru arderea de 200 de litri de benzină?
cuplarea oxidativă a alchinelor și stadiul acesteia. Sinteza acetoxilare de etilenă și oxid de olefine. Prepararea de aldehide și cetone la alcooli cu catalizatori metalici și oxid de dehidrogenare. Reacția de oxidare într-o chimie anorganică industrială.
Acetilena - gaz incolor, cu miros ușor dulceag. Un studiu al producerii de acetilenă prin diverse metode: elektrokrekingom (metan), cracare termică (propan lichid) și piroliza termică oxidativă de metan din gazele de reacție.
hidrocarburi saturate. hidrocarburi nesaturate. Aromatice sau Arena Cicloalcani Alchenele alcanilor diene Alchinele 1. Formula generală CnH2n -metan
Proprietățile fizice și chimice ale glicolului. Schemele tehnologice care produc etilenă hidratare okisietilena. O metodă de producere a uleiurilor esențiale. Principiul coproducția tehnic etilenglicol și catalizator în pat fix okisietilena.
hidrocarburi saturate. hidrocarburi nesaturate. Aromatice sau Arena Cicloalcani Alchenele alcanilor diene Alchinele 1. Formula generală CnH2n -metan