Cantitatea de gaz dizolvat într-o unitate de volum soluție nazyvaetsyarastvorimostyu: m 3 / m 3 g / l mol / l, etc ...
Solubilitatea gazului în lichid determină abilitatea unui amestec component de gaz sau de gaz pur formează un soluții lichide omogene.
Solubilitatea gazului crește cu presiune în creștere:
F, mm Hg. Art. 102 390 874 1160
g, g / l 10,6 2,74 24,0 31,6
Gazul din volatilitatea ridicată a forței nu poate fi dizolvat în lichid și deja într-un echilibru concentrație infinit de mic este stabilită „gaz soluție“ nu este pur și simplu o soluție și o soluție saturată la un anumit p și T.
dizolvare gaz ideal proces la presiuni relativ scăzute. în absența interacțiunii chimice a gazului cu un lichid, este descris de către Henry (. William uchon.1774-1836 Eng), deschide-le 1803 an, care prevede: „Numărul de gaz dizolvat într-un lichid este direct proporțională cu presiunea asupra soluției la o temperatură constantă“.
unde K - constanta lui Henry, 1 / Pa, 1 / bar, 1 / atm;
p - presiunea totală, Pa, bar atm.
În cazul în care este dizolvat gazul curat (un component), valoarea p este egală cu presiunea totală. iar în cazul în care amestecul de gaz se dizolvă, apoi valoarea p va fi caracterizat prin presiunea parțială (pi) de gaz dizolvat în componenta lichidă:
legea lui Henry este un caz special al legii generale a Dalton.
Presiunea parțială a componentului din amestecul gazos se calculează cu formula:
unde pi - presiunea parțială a componentului i-lea;
P tot - presiunea totală a amestecului gazos;
Expression (2) - expresia legii lui Henry-Dalton.
Vg / Vl Þ V2 ® fracție volumică a gazului dizolvat, care, pentru un gaz ideal este egală cu fracția molară (x2) Þ consecință a legii lui Avogadro. x2 = KG # 8729; p2.
Expresia legii lui Henry Dalton-scrisă ca:
unde xi - fracția molară a gazului dizolvat.
Ki - Henry componenta constantă a gazului i-lea;
pi - presiunea parțială a componentei gazului i-lea amestec.
Ecuația (4) altă formă, cu care suntem familiare extrem de soluții diluate (ORS). În reală extrem soluțiile diluate ale solventului (x1) este satisfăcută legea lui Raoult. și pentru substanța dizolvată lichidă (x2) - legea lui Henry.
Pentru soluții lichide de THC în lichide, cu presiuni comparabile de vapori saturați Henry a găsit experimental. La concentrații scăzute, presiunea de vapori a solutului este proporțională cu fracția molară
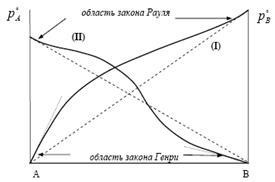
gdekG - constantă empirică (constanta lui Henry), care are o dimensiune de presiune. Dacă vom compara expresia 5 din legea lui Raoult (d-lui Raul Þ ), Apoi urmează chtokG @
Cu toate acestea, factorul de proporționalitate este diferită de presiunea de vapori saturați de substanțe pure: ¹ kg p o i
Constanta lui Henry este definit ca panta tangentei la curba presiunii experimentale în funcție de compoziția perechii soluție când x2 ®0.
Constanta lui Henry este determinată prin extrapolarea datelor experimentale:
Când x2 ®1, kg ® r o 2 și obținem legea lui Raul.
Comparăm aceste două forme (4)
În practică, solubilitatea gazului nu este de obicei exprimat în fracțiuni molare, și în unități de volum prin expresia (1). . (6)
Raportul dintre solubilitate a presiunii (la T = const) este constanta lui Henry:
și are semnificația fizică a coeficientului de solubilitate al presiunii parțiale a gazului egal cu unitatea, 1 bar, 1 MPa, 1 atm.
Solubilitatea gazului Măsura în lichid este coeficientul de solubilitate (a), care indică cantitatea dizolvată în (soluție) lichid la o serie de date de temperatură și presiune a gazelor (P și T) condiții:
în cazul în care un - coeficientul de solubilitate a gazului (coeficient Bunsen), m 3 / m 3.
Expresia analitică a metodei legii termodinamic lui Henry poate fi derivată din Gibbs-Duhem:
unde x1 și x2 - fracția molară de solvent (1 - lichid) și solutului (2 - Dioxid);
m 1 și m2 - chimice potentiale ale solventului și solutului.
Potențialele chimice pot fi determinate de următoarele expresii:
unde p1 și p2 - solvent parțial și gazele dizolvate.
Diferențierea expresia (9), diferențialele din potentialele chimice:
Substituind expresia (4.10) în ecuația originală Gibbs-Duhem (8):
Selectați dlnp2 din ecuația (11):
Această ecuație poate fi convertit în această formă:
Presiunea parțială a aburului cu proprietăți ideale pentru solvent poate fi determinat prin legea Raoult și exprimă în termeni de presiune a vaporilor saturați:
Diferențierea (14) în conformitate cu x1. . înlocuind în (13) obținem următoarea ecuație:
Ia integrala nedefinită a ecuației (15), odată cu introducerea integrării constantelor lnk, unde Kg - constanta lui Henry:
După o potențare a expresiei (4.16) obținem ecuația legii lui Henry:
Pe baza acestei ecuații, spune legea lui Henry. „La o temperatură constantă, presiunea parțială a volatile (gazos) component (p2), este direct proporțională cu fracția molară în lichid (x2)“.
Această formulare a legii lui Henry se aplică în cazul în stare de gaz dizolvat dezvoltă bo ¢ presiune a vaporilor mai mare (p o r) comparativ cu presiunea de vapori a solventului pur (p o p), ceea ce este tipic pentru gaz. În acest caz, atât soluția substanței (gaz și solvent) este chimic inert. Valorile de dimensiune kg în ecuația (17) este aceeași ca și presiunea parțială.
Solubilitatea gazelor în lichide este direct proporțională cu presiunea parțială a gazului (p) deasupra suprafeței lichidului :.
Constanta lui Henry este constantă pentru substanța i-lea la o temperatură dată, modificați o temperatură valoarea acestuia variază în funcție o lege exponențială. Valorile K pentru diferite sisteme sunt date în referințele privind proprietățile termodinamice ale substanțelor.
In general, constanta Henry depinde de natura gazului, natura solventului și temperatura.
La presiuni ridicate (peste 1¸1,2 MPa), sau când proprietățile soluției imperfecte de gaz. care pot avea loc la concentrații relativ ridicate de gaze dizolvate într-un solvent, în termenii legii lui Henry este folosit în loc de fugacitatea valori ale presiunii:
unde fg - fugacitate (volatilitate) a gazului;
Coeficientul de fugacitate care depinde de p și T. - gf
Principiul Le Chatelier lui. Pe sistemul termodinamic într-o stare de echilibru stabil, poate afecta factorii externi, sculpta-l din această stare. Sistemul de reacție pentru aceste efecte pot fi determinate calitativ pe baza principiului Le Chatelier-Braun, propus în 1884 de chimistul francez Henri Lui Le Chatelier (1850-1936 ani), și sa stabilit în 1887 de fizicianul german Karl Ferdinand Braun (1850-1918 g x): „. influențe externe, deducând sistem termodinamic dintr-o stare de echilibru stabil, făcându-l să curgă procese care reduc impactul acestor perturbații externe“