Prezența „neotnimaemoy“ la absolut zero energie nu este o proprietate specială a heliului. Se pare că energia „zero“ disponibile pentru toate substanțele. Numai heliu această energie este suficientă pentru a preveni atomii formează o rețea cristalină regulată.
Nu cred că heliu nu poate fi într-o stare cristalină. necesar pentru cristalizarea heliu crește doar presiunea la aproximativ 25 atm. Răcirea se realizează peste această presiune va avea ca rezultat formarea unui solid cristalin cu o proprietăți heliu în întregime convenționale. Heliul formează o rețea cubică cu fețe centrate.
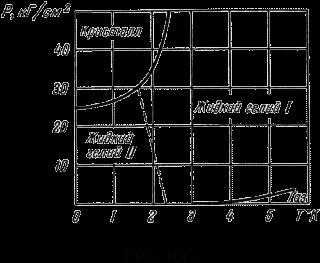
Fig. 106 prezintă o diagramă a heliului. Este foarte diferit de toate celelalte substanțe diagrame lipsesc punctul triplu. De fierbere și de topire curbe nu se intersectează.

Ce soluție
Dacă supa cu sare și se amestecă cu o lingură, iar apoi vor exista urme de sare. Noi nu ar trebui să credem că granulele de sare pur și simplu nu sunt vizibile cu ochiul liber. Cristale de sare, în nici un fel nu poate fi detectată pentru motivul că acestea sunt dizolvate. Dacă podbavit în bulion piper, soluția nu va funcționa. Puteți amesteca chiar și bulionul de zile - pete mici negre dispar.
Dar asta înseamnă - „soluție de substanță“? La urma urmelor, atomii sau moleculele din care este construit, nu poate fi abis fără urmă? Bineînțeles că nu, ele nu dispar. La dizolvarea dispare cristal numai substanță grăunte, concentrația moleculelor de un anumit tip. Dizolvarea este apoi agitarea unui amestec de particule, în care moleculele de o singură substanță distribuite între molecule diferite. Soluția - un amestec de molecule sau atomi de substanțe diferite.
Soluția poate conține cantități variabile de solut. Compoziția soluției se caracterizează prin concentrația sa, de exemplu, raportul dintre numărul de grame de solut la numărul de litri de soluție.
Deoarece adăugarea soluției solutului concentrația crește, dar nu la nesfârșit. Mai devreme sau mai târziu, soluția devine saturată și se oprește „ia o“ solut. Concentrația de soluție saturată, adică, „Marginal“ concentrarea soluției, numită solubilitate.
Surprinzător, o mulțime de zahăr poate fi dizolvat în apă fierbinte. La o temperatură de 80 ° C, sticlă de apă nu va reziduu 720 g de zahăr. Această soluție saturată este gros și vâscos, bucătari numesc un sirop de zahăr. Suntem condus la cifra de pahar de sticlă de zahăr, cu o capacitate de 0,2 litri. Prin urmare, concentrația de zahăr în apă la 80 ° C egală cu 3600 g / l (a se citi: „grame pe litru“).
Zahăr și sare sunt ușor solubile în apă. Dar naftalină în apă, practic insolubil. Diferite substanțe în diferiți solvenți se dizolvă complet diferite.
Soluția utilizată pentru cultivarea monocristale. Dacă atârnate în soluție saturată de un cristal mic de un solut, evaporarea solventului ca solut va ateriza pe suprafața cristalitelor. În acest caz, molecula va urma o ordine strictă și ca urmare a unei mici rândul său, într-un cristal mare, rămânând singur cristal.
Soluții de lichide și gaze
Este posibil să se dizolve fluidul în fluidul? Desigur, poți. De exemplu, vodca - este o soluție de alcool în apă (sau, dacă se dorește, apa, un alcool, - în căutarea mai mult). Vodka - o soluție reală, moleculele de apă și alcool complet amestecat în ea.
Cu toate acestea, nu întotdeauna prin amestecarea a două lichide obține acest rezultat.
Încercați să toarne kerosen apă. Nici o amestecare nu va fi în măsură să obțină o soluție omogenă, este la fel de fără speranță ca să se dizolve piper în supă. După ce se oprește agitarea, fluidul în straturi: o apă grea - în partea de jos, kerosen brichetă - în partea superioară. Kerosen cu apă și alcool cu apă - un sistem de proprietăți de solubilitate opuse.
Cu toate acestea, există cazuri intermediare. Dacă se amestecă aerul cu apă, atunci putem vedea în mod clar în vasul de două straturi. La prima vedere poate părea că pe partea de sus a aerului, și sub apă. De fapt, și cel inferior și stratul superior sunt soluții: în partea de jos - apă, în care esterul dizolvat porțiune (concentrație de 25 g ester per litru de apă), iar partea de sus - ester, care are o cantitate semnificativă de apă (60 g / l).
Acum pointeresuemsya gaze soluții. In mod clar, toate gazele sunt dizolvate unul în celălalt în cantități nelimitate. Două gaz este întotdeauna amestecat, astfel încât moleculele penetrează între moleculele unul pe altul. Într-adevăr, câteva molecule de gaz interacționează unele cu altele, și fiecare gaz se comportă în prezența unui alt gaz, într-un sens, nu acordând o „atenție“ partenerului său.
Gaze pot dizolva în lichide. Cu toate acestea, nu în orice cantitate și într-un număr limitat, nu este diferit în această privință de solidele. În acest caz, gazele diferite sunt dizolvate în moduri diferite, iar aceste diferențe pot fi foarte mari. Apa poate dizolva cantități mari de amoniac (în jumătate de pahar de apă rece - circa 100 g), cantități mari de hidrogen sulfurat și bioxid de carbon. Cantitatea mică de oxigen este solubil în apă și azot (0,07 și 0,03 g per litru de apă rece). Astfel, într-un litru de apă rece este de numai aproximativ o sutime de gram de aer. Cu toate acestea, această cantitate mică joacă un rol important în viața de pe Pământ - de fapt, dizolvat în apă de oxigen în pește de respirație de aer.
Cu cât presiunea gazului, mai mult se va dizolva în lichid. În cazul în care cantitatea de gaz dizolvat nu este foarte mare, presiunea între ea și gazul există o proporționalitate directă deasupra suprafeței lichidului.
Cine nu se bucură de un sifon de apă rece, sete atât de bine stingator! Prepararea apei carbogazoasă este posibilă datorită dependenței presiunii gazului dizolvat. Dioxidul de carbon este condus sub presiune în apă (de cilindri, care sunt fiecare chioșc care vinde apa carbonatată). Când apa este turnat într-un pahar, presiunea scade la presiunea atmosferică și apa extrage „extra“ gaz sub formă de bule.
Având în vedere aceste efecte, scafandri nu poate fi ridicat rapid din apă la suprafață. Sub presiune ridicată la adâncimea scafandrului în sânge se dizolvă cantitatea suplimentară de aer. La ridicarea căderile de presiune, aerul începe să se separe ca bule și poate bloca vasele de sânge.
În viață, cuvântul „soluție“ este aplicată lichidului. Cu toate acestea, există amestecuri solide, atomi sau molecule sunt amestecate în mod omogen. Dar cum să obțineți soluțiile solide? Cu ajutorul unui mojar nu le va primi. Prin urmare, se amestecă substanțele trebuie să facă mai întâi un lichid, adică topit, apoi se amestecă lichidul și se lasă amestecul să se solidifice. Puteți face un alt lucru - pentru a dizolva cele două substanțe care dorim să se amestece în orice lichid, și apoi să se evapore solventul. Astfel de metode pot dovedi soluții solide. Poate obține, de obicei, dar nu pot fi obținute. Soluțiile solide - este o raritate. Dacă apa sare pentru a arunca o bucată de zahăr, este perfect dizolvat. apa Evaporat; apar în partea de jos a unei cești de cristale fine de sare și zahăr. Sare și zahăr nu oferă soluții solide.
Acesta poate fi topit într-un creuzet, cadmiu și bismut. După răcire, vom vedea la microscop un amestec de cristale de bismut și cadmiu. Bismuth și cadmiu, de asemenea, nu formează soluții solide.
Este necesar, deși nu suficientă, pentru apariția unor soluții solide este apropierea moleculelor sau atomilor de substanțe în formă și dimensiune de amestecare. În acest caz, un fel de cristale formate în timpul înghețării amestecului. Nodurile fiecare rețea cristalină atomii de obicei populate aleator (molecule) de diferite grade.