Pentru formulele și legile fizicii au fost mai ușor de înțeles și de a folosi tot felul de modele utilizate și simplificare. Acest model este gaz ideal. Modelul în știință - este o copie simplificată a sistemului de reale.
Modelul reflectă caracteristicile esențiale și proprietățile proceselor și fenomenelor. Modelul gazului ideal ia în considerare numai proprietățile de bază ale moleculelor, care sunt necesare pentru a explica baza comportamentului gazului. Un gaz ideal seamănă cu gaz real, într-un interval destul de îngust de presiune (p) și temperatura (T).
Cea mai importantă simplificare a gazului ideal este faptul că energia cinetică a moleculelor este considerată a fi mult mai mare decât energia potențială a interacțiunii lor. Descrie ciocnirea moleculelor de gaz prin intermediul unor legi bile coliziune elastice. Mișcarea moleculelor este considerată drept în intervalele dintre coliziuni. Aceste ipoteze fac posibilă obținerea ecuației speciale, care se numește ecuația de stare a gazului ideal. Aceste ecuații pot fi utilizate pentru a descrie starea de gaz reale la temperaturi și presiuni scăzute. ecuația de stare, și poate fi numit formule pentru gaz ideal. Aici, de asemenea, alte formule de bază, care sunt utilizate în studiul comportamentului și caracteristicile unui gaz ideal.
Ecuația de stare a unui ideal
Ecuația Mendeleev - Clapeyron
unde p - presiunea gazului; V - volumul de gaz; T - temperatura gazului în grade Kelvin; m - masa de gaz; - masa molară a gazului; - constanta universală a gazelor.
Ecuația gazului Ideal de stat este, de asemenea, expresia:
unde n - concentrația moleculelor de gaz în acest volum; .
Ecuația fundamentală a teoriei moleculare cinetice
Folosind acest model ca un gaz ideal, ecuația de bază este obținută teoria cinetică moleculară (ICB) (3). Ceea ce indică faptul că presiunea gazului este rezultatul unui număr enorm de accidente vasculare cerebrale ale moleculelor sale pe peretele vasului, în care gazul este.
unde - energia cinetică medie a mișcării de translație a moleculelor de gaz; - concentrația moleculelor de gaz (N - numărul de molecule de gaz în vas; V - volumul vasului); - masa moleculelor de gaz; - viteza efectivă a moleculei.
Energia interna a unui gaz ideal
Deoarece gazul ideal pentru a primi energie potențială de interacțiune dintre molecule este egal cu zero, energia internă este egală cu suma energiilor cinetice ale moleculelor:
unde i - numărul de grade de libertate a moleculelor unui gaz ideal; - numărul lui Avogadro; - cantitatea de substanță. Energia interna a unui gaz ideal este determinată de temperatura termodinamica (T) și proporțională cu masa.
Activitatea unui gaz ideal
Pentru un gaz ideal în procesul de lucru izobară () se calculează cu ajutorul formulei:
În exploatare a gazului de proces izocoră este zero, deoarece nu există nici o schimbare în volum:
Pentru procedeul izoterma ():
Pentru procesul de adiabatică () operațiune este:
unde i - numărul de grade de libertate a moleculelor de gaz.
Exemple de rezolvare a problemelor legate de „Ideal Gas“
Care este densitatea amestecului de gaze ideale la temperatura T și presiunea p, în cazul în care masa de gaz și o masă molară, masa molară a doua masa gazului?
Prin definiție, o densitate de substanță omogenă () este:
unde m - masa totală a materialului; V - volumul său. amestec de gaze în masă este suma componentelor individuale ale unui amestec:
Rămâne să găsească volumul, care ia amestecul de gaze în condiții predeterminate. Pentru a face acest lucru, vom scrie ecuația lui Mendeleev - Clapeyron pentru amestec:
în care cantitatea de amestec substanță () a constatat ca:
Exprimă volumul amestecului, folosind (1.4):
Noi înlocui (1,2) și (1,5) până la (1.1), obținem:
Alegeți din următoarele procese, care procedeu într-un gaz ideal corespunde graficului prezentat în figura 1? Izocoră, izobară, adiabatic.
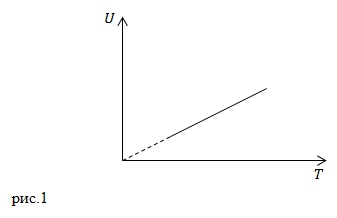
Energia interna a unui gaz ideal este determinată ca:
Este proporțională cu temperatura procesului. La o greutate constantă de același gaz în procesele izocoră, izobare și adiabatice, obținem graficul prezentat în figura 1