Cinetica reacțiilor enzimatice. Studiile cinetici accelerarea reacțiilor mecanisme și efectele factorilor, cum ar fi concentrația de enzime și substraturi, tempera-călătorie, pH, prezența inhibitorilor sau activatorilor.
La concentrații constante de substrat viteza de reacție este direct proporțională cu concentrația enzimei. Un grafic al ratei reacției enzimatice din con-centrarea de substrat are forma unui hiperbolă echilateral.
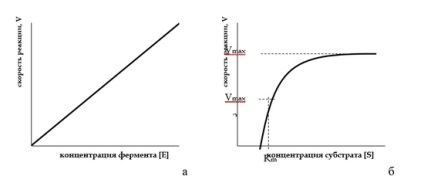
Dependența ratei reacției enzimatice a unei concentrații de enzimă (a) și substrat (b)
Dependența vitezei de reacție enzimatică pe concentrația substratului este descrisă de Michaelis - Menten ecuație.
unde V - o viteză staționară a reacțiilor biochimice; Vmax - viteza maximă; Km - constanta Michaelis; [S] - concen-trarea substrat.
În cazul în care concentrația substratului este scăzută, adică. E. [S] <<Кm, то [S] в знаменателе можно пренебречь.
Astfel, concentrațiile direct propor ționale substrat și descrierea INDICA ecuație de ordinul întâi la viteza de reacție a substratului de concentrație scăzută Rep. Această co-sponds la linie dreaptă inițial de predare-stku [S] curba V = f (figura b).
La concentrații ridicate ale substratului [S] >> Km Km unde poate fi neglijată, ecuația Michaelis - Menten ecuație ia forma, adică V = Vmax.
Astfel, la concentrații mari de substrat vitsya viteză de reacție STAN descrisă ecuație de ordinul zero și maximă. Aceasta corespunde porțiunii din curba V = f [S], paralel cu abscisa.
La concentrații de substrat comparabile numeric cu constanta Michaelis-una, crește viteza de reacție treptat. Acest lucru este în concordanță cu conceptele mecanismului de enzima rea-TION:
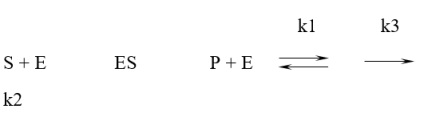
unde S - substratul; E - enzimă; ES - Enzyme substrat complex-Lex; P - produs; k1 - rata constanta de formare a complexului enzimă-substrat; k2 - constanta vitezei de descompunere a complexului enzimă-substrat pentru a forma reactanții inițiali; k3 - rată constantă dezintegrare a complexului produs wi-mations-enzimă substrat.
Rata de conversie a substratului pentru a produce un produs (P) este proporțională cu concentrația de pro-enzimă-substrat complex [ES]. La concentrații scăzute de substrat în soluție are un număr de molecule libere ale enzimei (E) nu este conectat la complex (ES). Prin urmare, prin creșterea concentrației de concentrația substratului crește com-plexes, prin urmare, crește și viteza de formare a produk-ta. La substrat înalt concentrațiile moleculele enzimatice toate legate la ES complexe (fenomen de saturație al enzimei), astfel încât creșterea distanțe termoaplic în concentrația substratului nu crește, practic, concentrarea Vaeth și viteza de formare a complexelor produsului rămâne constantă.
Astfel, devine clar semnificație fizică a vitezei maxime a reacției enzimatice. Vmah - este rata la care enzima reactioneaza complet exista sub forma de complex enzimatic-sub-stratnogo.
Formă numerică constantă Michaelis corespunde unei Concentra-TION a substratului la care rata starea de echilibru este maximă la jumătate. Această constantă caracterizează constantele con de disociere a complexului enzimă-substrat:
Sensul fizic al constanta Michaelis este că polarizează Caracteristici, afinitatea enzimei la substrat. Km are valori mici când k1> (k2 + k3), adică formarea proceselor de transformări complexe ES-over posedă ES disociere. În consecință, sunt mai mici m valorile K, afinitatea enzimei la substrat mai mult. Și, invers, gura, în cazul în care Km este de mare importanță, conexiunea (k2 + k3)> procese k1 și ES disociere prevalează. În acest caz, afinitatea enzimei la substrat este mic.
Inhibitori și activatori ai enzimelor. Inhibitorii enzimei sunt substanțe care reduc activitatea enzimelor. Orice agenți de denaturare (de exemplu, săruri ale metalelor grele, acizi) sunt enzime nespecifice set-ingibito.
Inhibitorii reversibili - sunt compuși care interacționează necovalent cu enzima. inhibitori ireversibili - sunt compuși de legare în mod specific gruparea funcțională a centrului activ și formează legături covalente cu enzima.
inhibare competitivă reversibilă și au fost separate pe o închiriere-nekonku. Inhibarea competitivă implică inhibitor structural convergent TION și substrat. Inhibitor are loc în situsul activ al enzimei, și un număr semnificativ de molecule de enzime este numit un ochi-blocat. Inhibarea competitivă poate fi îndepărtată, în cazul în care creșterea concentrației de substrat. În acest caz, substratul este aglomera te-inhibitor competitiv al site-ului activ.
inhibarea reversibilă poate fi necompetitiv în substrat relație-SRI. În acest caz, inhibitorul nu concurează pentru site-ul de legare pentru enzima. Substratul și se leagă de inhibitor la centrele de timp-TION, astfel încât există posibilitatea formării IE complexe precum IES complexe ternare, care pot fi date, cu eliberarea descompune produsului, dar într-un ritm mai lent decât Comp lex ES.
Prin natura inhibitorilor sale de acțiune sunt împărțite în:
Inhibitorii specifici exercita efectul lor asupra enzimei, care unește o legătură covalentă în situsul activ al enzimei și transformându-l din domeniul de aplicare.
inhibiția nespecifică implică expunerea agenților de denaturare-fer ment (săruri de metale grele, uree, etc.). În acest caz, în distrugerea structurii proteinei cuaternară și terț clorhidric este o pierdere a activității biologice a enzimei.
Activatori enzime - sunt substanțe care măresc viteza reacției Fermi-comutativă. Cel mai adesea acționează ca activatori ai ionilor metalici de captură (Fe2 +, Fe3 +, Cu2 +, Co2 +, Mn2 +, Mg2 +, etc.). Distinge metale în compoziția metaloenzime care sunt cofactori, și pas cu pas pentru ca activatori ai enzimelor. Cofactori sunt puternice legături-vatsya la partea de proteine a enzimei, ca și pentru promotorii, acestea sunt ușor separate de apoenzimei. Aceste metale sunt utilizator obligatoriu eveniment catalitica mi determinarea activității enzimei. Activatori Wuxi Liban-acțiune catalitică. dar absența lor nu interferează cu reacția enzimatică Protek-INJ. De obicei, din metal-cofactor interacționează cu grupurile încărcate negativ ale substratului. Metal cu valența variabilă este implicat în schimbul de electroni între substrat și enzimă. În plus, ei participă la formarea unei tranziții conformație sută de decoletat a enzimei, ceea ce contribuie la formarea mai rapidă a complexului mu-ES.
Reglementarea activității enzimei. Unul dintre mecanismele de bază de reglementare metabolică este reglarea activității enzimei. Un exemplu este reglarea alosterică, reglarea prin activatori și inhibitori. Se întâmplă adesea ca calea produsului final este un inhibitor al enzimei de reglementare. Acest tip de inhibare se numește inhibarea feedback-ului, sau inhibarea feedback-ului negativ.
Multe enzime sunt produse ca inactive predshe-stvennikov-proenzime și apoi activate la momentul potrivit datorită proteolizei parțiale. Parțială proteoliza - clivaj al moleculei, ceea ce duce la o schimbare în structura terțiară a proteinei și formarea centrului activ al enzimei.
Unele enzime oligomeri pot schimba activitatea prin asocierea - disocierea subunităților. în termen de a deveni co-lor.
Multe enzime pot fi în două forme: ca un pro-proteine și granulată ca fosfoproteida. Trecerea de la o formă la Dru-Guyu însoțită de o schimbare a activității catalitice.
Viteza reacției enzimatice depinde de cantitatea de enzimă. care într-o celulă este determinată printr-un raport de viteza de sinteză și degradare. Acest mod de reglare a vitezei de reacție enzimatică este un proces mai lent decât reglementarea activității Fer-ment.