Proteine. Structura proteinelor. Proprietățile de proteine.
Protein - o secvență de aminoacizi legați împreună prin legături peptidice.
Se poate imagina cu ușurință că numărul de aminoacizi poate fi diferit de cel puțin două până la orice valoare rezonabilă. Biochimiști a fost de acord să se presupună că în cazul în care numărul nu depășește 10 aminoacizi, compusul este denumit peptidă; Dacă 10 sau mai mulți aminoacizi - polipeptidă. Polipeptidele capabile să formeze în mod spontan și să păstreze anumită structură spațială, numită conformație, denumite proteine. Stabilizarea unei astfel de structuri este posibilă numai atunci când polipeptidele lungime definită (40 aminoacizi), totuși proteinele considerate de obicei, polipeptide cu greutate moleculară mai mare decât 5000 Da. (1Yes egal cu 1/12 izotop de carbon). Numai prin a avea o anumită structură spațială (structura nativă), proteina poate îndeplini funcțiile.
Dimensiunea proteinelor poate fi masurata in daltoni (greutate moleculară), cel mai adesea din cauza unei valori relativ mari într-o moleculă derivată unități - kilodaltoni (kDa). proteine de drojdie, în medie, compusă din 466 aminoacizi și au o greutate moleculară de 53 kDa. Cel mai mare dintre proteine cunoscute în prezent - Titina - este o componentă a sarcomeres musculare; greutate moleculară a diferitelor sale izoforme variază în intervalul 3000-3700 kDa, este alcătuită din 38 de 138 aminoacizi (Solius muscular uman).
Structura tridimensională a unei proteine formate în timpul plierii (de pliere englezesc -. «Plierea"). Structura tridimensională este formată prin interacțiunea dintre structurile la niveluri inferioare. Există patru niveluri de structuri de proteine:
Structura primară - secvența de aminoacizi din catena polipeptidică.
Structura secundară - este în ocuparea spațiului de porțiuni ale lanțului polipeptidic. Următoarele sunt cele mai comune tipuri de structuri secundare de proteine:
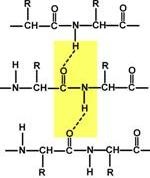
# 945; helix - bobine strâns în jurul axei lungi a moleculei, se transforma cu 3,6 resturi de aminoacizi, și pasul elicoidal este de 0,54 nm (un rest de aminoacid are la 0,15 nm), helix stabilizat prin legături de hidrogen între H și O grupuri de peptide distanțate de un rest de acid 4 amino. Spirala construite numai de un singur tip de aminoacizi stereoizomeri (L). Cu toate că poate fi atât de stângaci și pravozakruchennoy în proteine predomină pravozakruchennaya. Spirala perturba interacțiunile electrostatice ale acidului glutamic, lizina, arginina. Plasat aproape unul de altul resturi de asparagină, serină, treonină și leucina poate împiedica steric formarea unei spirale, resturile de prolină cauzează lanț de îndoire și, de asemenea, poate perturba structura # 945; helix.
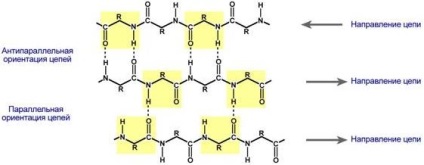
# 946; -skladchatye straturi - mai multe lanțuri polipeptidice în zig-zag, în care se formează legături de hidrogen între relativ îndepărtate unul față de celălalt (0,347 nm la resturi de aminoacizi), în structura primară sau aminoacizi cu lanțuri diferite de proteine și nu spațiate strâns, așa cum este cazul în # 945; helix. Aceste lanțuri sunt de obicei capetele N-dirijate în direcții opuse (orientare antiparalel). pentru educație # 946; straturi -skladchatyh de mici dimensiuni sunt importante grupuri laterale de aminoacizi, de obicei, dominat de glicină și alanină.
De stabilire de proteine în formă de # 945; helix
De stabilire de proteine în formă de # 946; -skladchatogo strat
Structuri dezordonate - un aranjament neordonat al lanțului proteic în spațiu.
Structura spațială a fiecărei proteine este individuală și este determinată de structura sa primară. Cu toate acestea, compararea diferitelor conformații ale structurii și funcțiilor proteinelor a arătat că acestea au combinații similare ale elementelor de structură secundară. O astfel de procedură pentru formarea unei structuri secundare specifice de proteine numite structuri supervtorichnoy. Structura Supervtorichnaya formată interacțiunile mezhradikalnyh datorate.
Anumite combinații de caracteristici # 945; helices și # 946; -structures adesea menționată ca „motive structurale“. Ei au un anumit nume: "# 945; helix-povorot- # 945; Helix", „structură # 945; / # 946; -bochonka "" fermoarului de leucină "" zinc deget „et al.
Structura terțiară - o metodă de plasare a întregului în spațiul lanțului polipeptidic. împreună cu # 945; helix, # 946; -skladchatymi straturi supervtorichnymi și structuri în structura terțiară a constatat conformație dezordonată, care poate lua o parte semnificativă a moleculei.
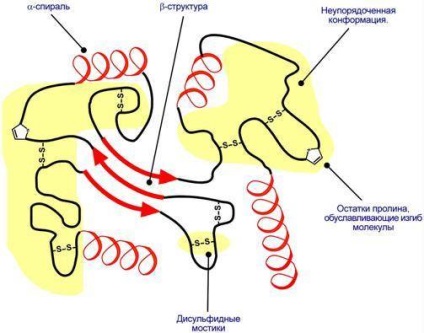
Reprezentarea schematică a proteinei pliere în structura terțiară.
Structura cuaternară apare în proteine care constau din mai multe lanțuri de polipeptide (subunități sau monomeri protomers), prin combinarea acestor subdinits structuri terțiare. De exemplu, molecula de hemoglobina este compus din 4 subunități. Formarea structurii cuaternară sunt supramoleculare - multienzimatic complecși care sunt compuse din mai multe molecule de enzime și coenzime (piruvat dehidrogenază) și izoenzimele (LDH - lactat dehidrogenaza, creatinfosfokinazei -KFK).
Deci Structura spațială nu depinde de lungimea lanțului polipeptidic, și secvența resturilor de aminoacizi specifici pentru fiecare proteină, dar, de asemenea, din partea radicalilor corespunzând aminoacizilor caracteristice. structură tridimensională spațială sau conformație macromoleculelor proteice formează în principal legături de hidrogen, interacțiuni hidrofobe între interacțiunea nepolar aminoacizi radical lateral, ionic între grupe laterale încărcate opus de resturi de aminoacizi. legături de hidrogen joacă un rol important în formarea și menținerea structurii spațiale a moleculei de proteină. În ceea ce privește interacțiunile hidrofobe, ele apar din contactul dintre radicalii nepolare, în imposibilitatea de a rupe legătura de hidrogen între moleculele de apă, care este deplasat pe suprafața Globula proteine. Ca sinteza proteinelor de grupare chimică nepolară în cadrul globulele sunt colectate și polare deplasate pe suprafața sa. Astfel, molecula de proteine poate fi neutru, încărcat pozitiv sau negativ în funcție de pH și grupările ionice solvent în proteină. Mai mult decât atât, conformația proteinelor este menținută prin legături covalente S-S, formate între două resturi de cisteină. Ca rezultat, formarea structurii proteinei native a multor atomi în locuri îndepărtate ale lanțurilor polipeptidice vin împreună și, acționând pe fiecare parte, să dobândească noi proprietăți care lipsesc din aminoacizi individuali sau polipeptide mici.
Este important să se înțeleagă că plierea - plierea proteinelor (și alte Biomacromolecules) din conformația desfăcută în forma „nativă“ - proces fizico-chimic, în care proteinele din „habitatul“ lor natural (soluție citoplasmă sau membrană) dobândesc unică pentru a le pliere spațială și funcția.
In celulele există un număr de proteine inactive care catalitica totuși contribuie în mare măsură la formarea structurilor spațiale ale proteinelor. Această așa-numita chaperones. Chaperones ajuta asamblarea corectă a conformației proteină tridimensională prin formarea unui reversibili complecși necovalente cu catena polipeptidică parțial pliată formată inhibând simultan conexiune incorectă care conduce la formarea structurilor de proteine inactive funcțional. Lista funcțiilor chaperone specifice includ protectie topit globulelor (parțial pliate) de agregare precum și transportul proteinelor nou sintetizate la diferite celule loci. Chaperones sunt, de preferință, proteine de șoc termic, a căror sinteză crește brusc la expunerea la stres temperatură, astfel încât acestea sunt numite hsp (proteine de șoc termic). Familie de proteine gasite in celulele microbiene, vegetale și animale. Chaperones Clasificarea în funcție de greutatea lor moleculară, care variază la 10 la 90 kDa. Acestea sunt proteine procese helper ale structurii tridimensionale a proteinelor. Chaperones hold nou sintetizat lanț polipeptidic în stare nepliată, nepermițând să se plieze în alta decât forma nativă, și să asigure condițiile pentru singura corectă, structura nativă a proteinei.
In timpul plierea moleculei proteice resping unele conformații în etapa a globulă topit. Degradarea unor astfel de molecule initiaza ubiquitin proteine. degradarea proteinelor de calea ubiquitin include două etape de bază: 1) atașarea covalentă a ubiquitin la degradarea supusă proteinei prin reziduuri de lizină, prezența unei astfel de proteine tag este ghid semnal de sortare primar format conjugați la proteazomal, în cele mai multe cazuri, la o proteină este atașată de mai multe molecule de ubiquitin care organizate sub formă de perle pe un șir de caractere.; 2) hidroliza proteosome proteină (funcția primară a proteazomului - degradarea proteolitică a proteinelor deteriorate și inutile la peptide scurte). Ubiquitin este numit binemeritat „desemnat pentru moarte“ pentru proteine.
domeniu de proteine - elementul structurii terțiare a proteinei, care este suficient de stabilă și independentă de substructură proteină a cărei pliere are loc independent de celelalte părți. Structura domeniului include, de obicei, mai multe elemente ale structurii secundare. Similar, în domenii de structură se regăsesc nu numai în proteine înrudite (de exemplu, hemoglobina diferite animale), dar și în complet diferite proteine. O proteină poate avea mai multe domenii, aceste site-uri pot avea diferite funcții în una și aceeași proteină. Structura de domeniu sunt unele enzime și toate imunoglobuline. Proteinele cu catene polipeptidice lungi (mai mult de 200 de resturi de aminoacizi) creează frecvent structuri de domeniu.