variația periodică a proprietăților ale elementelor prezentate în secvența explicată electroni de umplere nivelurile și subnivele în atomi cu creșterea numărului ordinal al încărcăturii elementului și nucleul atomului.
Deoarece configurația electronică a atomilor elementelor variază periodic, respectiv, sunt schimbate periodic și proprietățile elementelor care sunt definite prin structura lor electronică: Dimensiuni atomi caracteristici de putere, proprietăți de oxidare-vosstanovitelnymim. Principalele elemente ale proprietății chimice a atomilor lor este oxidarea sau reducerea capacității, care este determinată de poziția elementului din PSE. In perioada de la începutul până la sfârșitul activității de înlocuire este atomi atenuate și crește oxidarea, adică. E. O tranziție de atomi cu proprietăți atomi de metal tipic proprietăților tipice ale nemetale, atomi electronegative în creștere. In cadrul grupului de elemente (grupul principal), cu creșterea cantității de încărcare nucleu atomic crește nivelele de energie ale atomilor. Astfel, reducerea activității atomilor de grupe crește de sus în jos, și oxidare - este redus, iar amplitudinea scade atomii EO.
Se completează reacțiile în formă ionică moleculară, completă și abreviată
Examinarea numărul biletului 42
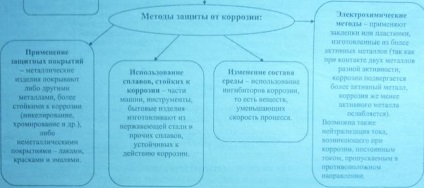
Metode pentru protecția metalelor împotriva coroziunii.
reacția de schimb între sare și apă - Hidroliza.
Sarea formată cu o bază puternică și un acid slab (mediu alcalin):
Na2CO3 + H2O = NaHCO3 + NaOH
Sarea formată o bază slabă și un acid slab (acid slab, mediu neutru, slab alcalin). Astfel de săruri sunt adesea descompuse de apă în întregime:
AL2S3 + 6H2O = 2AL (OH) 3 + 3H2S
Sarea formată o bază slabă și un acid puternic (acid):
CuCI2 + H2O = Cu (OH) CL + HCL
Nu suferi de sare de hidroliză formată cu un acid tare și o bază tare.
3. Ecuația Costavte totale ionice și moleculare corespunzătoare scurte ecuații de reacție:
NiOH + + H + Þ Ni2 + + H2O
NiOH + + NO3- + H + + NO3- Ni2 + + 2 NO3- + H2O
NiOHNO3 + HNO3 Ni (NO3) 2 + H2O
Examinarea numărul biletului 43
Acoperirea metalică aplicată prin galvanizare (electroliză galvanice), înmuierea părți într-o metodă de placare a metalului topit și cositorire (pulverizare termică).
Electroplacarea este utilizat ca un strat protector si decorativ de diverse produse din metal (acoperire cu crom, nichel, argint) și lacuri anticorosive elemente de fixare tuburi (acoperite cu zinc, cadmiu, cupru).
Principalele prevederi ale teoriei disocierii electrolitice S.Arreniusa.
1. Electrolitul în mediul apos (în stare topită) tind să se dezintegreze în ioni încărcați pozitiv (cationi) și ioni negativi (anioni). Ionii Proprietăți drastic diferite de cele ale atomilor neutri de elementele lor constitutive. Ioni în soluții apoase hidratate (complexele aqua). Astfel, un atom de sodiu neutru Na 1s 2s + 11 2 2 2p 6 3s 1 în condiții normale, se dă ușor exterior (3s 1) electronul (oxidat). Sodiu reacționează violent cu apa, acizi, chimic activ.
Ion (cation) de sodiu Na + 1s +11 2s 2 2 2p 6 nu pot dona electroni (oxida) nu reacționează cu apă.
2. aleatoare (haotică) mișcarea de ioni în soluție într-un câmp electric devine direcțională: ionii încărcați pozitiv (cationi) migrează la electrodul, încărcat negativ (catod), anioni și - la anod. Acest lucru explică conductivitatea ionică a soluțiilor apoase și electroliți topit.
Gidpatirovannye grupări hidroxil anioni care se deplasează la anod, colorate cu albastru de hârtie neutru (purpuriu). Turnesol
Cationii hidroniu H3 O +. se deplasează la catod, roșu de turnesol se colorează.
3. Procesul de disociere a electroliților în mediul apos (topituri) este reversibil:
ecuația de hidroliză 3. Să fie (NO3) 2. RB2 S, BaCl2 sub formă moleculară sau ionică. Specificarea pH.
bilet de examinare № 44