Acidul clorhidric este un electrolit puternic. În soluție, este aproape complet disociată:
Acesta este caracterizat prin toate comune proprietăți ale acizilor:
1. Reacționează cu metale între metale permanente tensiuni la hidrogen, metale adică având un electrod standard de potențial de hidrogen stramuta negativ de acid clorhidric:
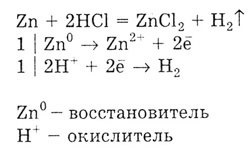
2. Acesta reacționează cu oxizii metalici, rezultatul este o sare și apă:
CuO + 2H + = Cu2 + H 2 0
3. Acesta reacționează cu baze insolubile și alcaline. Această reacție de neutralizare. Rezultatul este o sare și apă:
HCl + NaOH = NaCl + H 2 0
4. Reacționează cu săruri ale acizilor mai puțin puternice, rezultatul este o sare nouă și acid:
Acidul clorhidric este expune clor totuși starea de oxidare negativă este HCl reducătorul în reacții redox:

Sarcină. De ce acid fluorhidric nu pot fi stocate într-un recipient de sticlă? Scrieți ecuația reacției corespunzătoare.
Decizie. HF fluorhidric dizolvarea acidului și silicat de sticlă, astfel încât să nu poată fi depozitate în recipiente de sticlă: