Determinarea constantelor de disociere
Obiectiv: Pentru a determina gradul și constantele de disociere a unui acid organic slab la diferite concentrații.
Instrumente și reactivi:
1. complex de laborator educațional „Chimia“, cu următoarele elemente:
- Modulul „electrochimie“ complet cu doi electrozi de argint pentru măsurarea conductivității și un senzor termic;
- sticlă la 50 cm3;
2. Soluția de acid acetic având o concentrație de 0,1; 0,01; 0,001; 0,0001 M, apă distilată.
Conform teoriei Arrhenius, electroliți în soluție apoasă disociază în particule încărcate - ioni, care sunt purtători de energie electrică. Nu toate disociat Electroliții sunt la fel: una - electroliți puternici disociază complet în soluție; altele - electroliți slabi - doar parțial. În acest ultim caz, proporția de molecule rupte, numit gradul de disociere (), depinde de concentrația electrolitului și temperatura.
Într-o soluție a unui electrolit slab între moleculele nedisociat și ioni, se stabilește un echilibru
Pentru un electrolit binar:
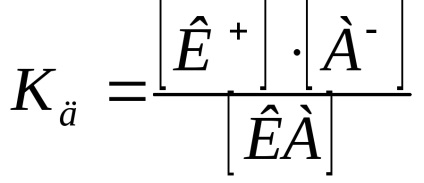
Echilibrul constant pentru disocierea procesului electrolitic numita constanta de disociere (Kd).
Să presupunem că gradul de disociere este . Dacă concentrația de acid în soluție este egală cu (mol / l), concentrația cationului
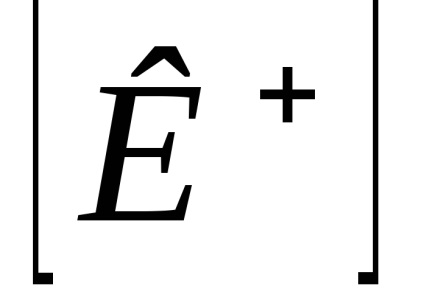
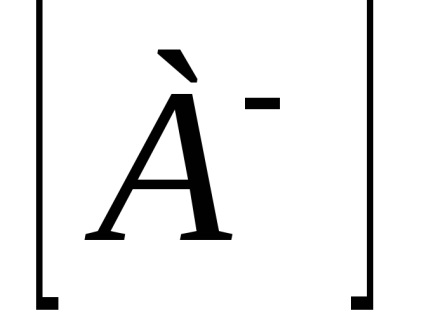
Calculat practic constantă Kd depinde de concentrația. Independent de concentrare este o disociere termodinamică constantă, exprimată în termeni de activitate a ionilor și moleculelor:
unde
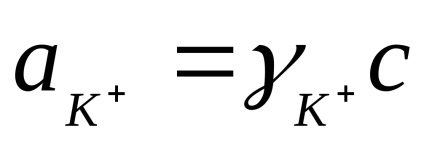
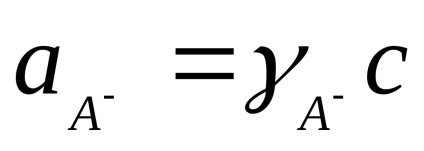
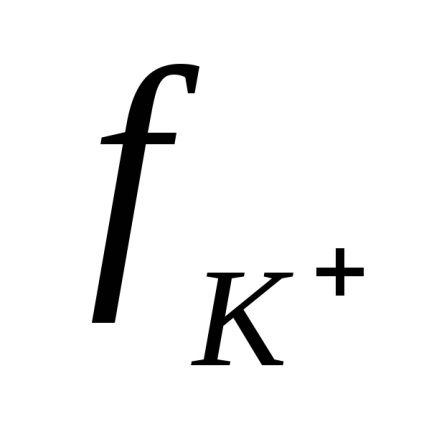
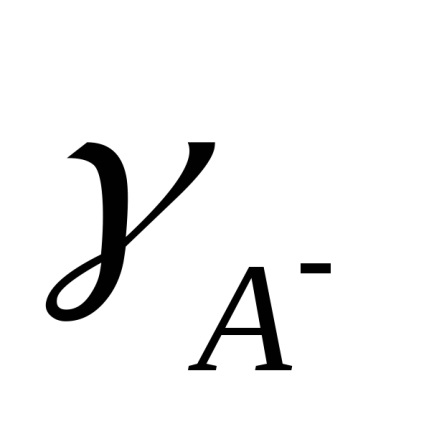
Ioni în soluția de electrolit sunt în mișcare aleatoare constantă. Atunci când un câmp electric extern privind mișcarea aleatorie a ionilor este aplicat orientat mișcarea de translație a suprafețelor cu electrozi: cationi - negativ și anioni - la electrodul pozitiv. Ca urmare, un curent electric.
Cantitatea, care caracterizează capacitatea unei substanțe de a conduce curentul electric de un câmp electric extern, numit conductivitate electrică.
Conductivitatea electrica (G) - inversul rezistenței electrice a conductorului (R). Măsurată în siemens (cm): A se vedea = ohm -1.
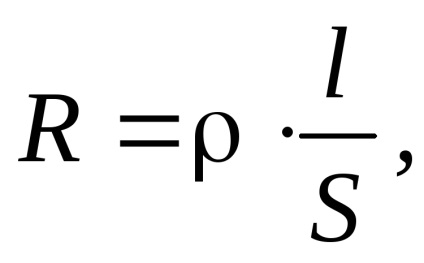
în care - rezistivitate; - conductivitate electrică specifică; S - aria secțiunii transversale a conductorului; l - lungimea conductorului.
Conductivitatea electrică în soluția de electrolit depinde de numărul de ioni în soluție vrac între electrozi și viteza lor.
Pentru a evalua conductivitatea soluției și influența diferiților factori sunt utilizate două cantități: specifice () și molar () conductivitatea electrică.
conductivitate electrică specifică () numit conductivitatea soluției, plasată între zona de electrod paralel de 1 cm 2 distanțate 1 cm. conductibilitatea electrică specifică măsurată în ohmi -1 sm Smsm -1 sau -1.
conductivitate electrică Molar - măsurarea conductivității electrice a tuturor ionilor formați prin disocierea unui mol de concentrație de electrolit dată.
conductivitate electrică molara este o conductivitate electrică a volumului (V cm3) de soluție, care conține 1 mol de substanță dizolvată, în care electrozii sunt distanțate 1 cm în afară.
Conductivitatea electrică specifică și raportul molar de legat
unde C - concentrația moll;
- conductivitate electrică molar (ohm -1 sm mol 2 -1) 2 sau Smsm mol -1;
- conductivitate electrică specifică (ohm -1 sm -1) -1 sau Smsm.
Deoarece conductivitatea electrică a volumului soluție de electrolit fiind determinat de numărul de ioni în aceasta, care transportă energie electrică, precum și rata lor de migrare la conductivitatea molară a relației
unde U +. U- - viteza absolută a mișcării ionilor (adică viteza de deplasare în domeniu, cu putere de 1 · cm-1 ..); - gradul de disociere a electrolitului; F - numărul lui Faraday, și anume cantitatea de energie electrică, care transportă un mol de cationi sau anioni individual ... încărcate
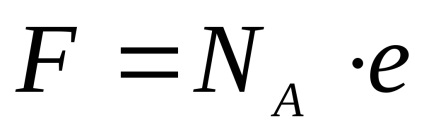
e - 1,610 -19 KI - taxa de electroni.
Când soluția diluată conductivitatea electrică molară a ambelor electroliți puternici și slabi crește: pentru electroliții slabi - datorită creșterii gradului de disociere (), pentru că puternic - prin creșterea vitezei absolute a mișcării de ioni
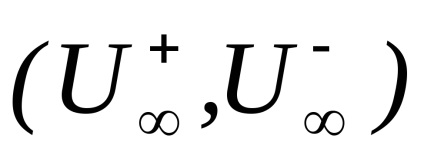
Valoarea limită . ipotetic soluție molară conductivitate electrică infinit diluată, caracterizată printr-o disociere completă a electrolitului și absența forțelor de interacțiune electrostatică dintre ionii conform (4) poate fi exprimat prin relația corespunzătoare
lucrările
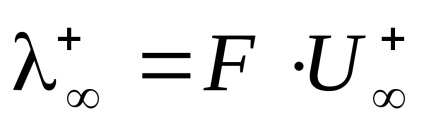
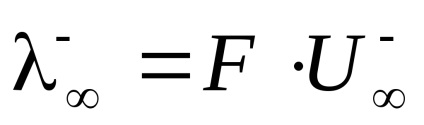
Molar electrolit conductivitate electrică la diluție infinită () egal cu suma mobilității limită de anioni și cationi.
Ecuația (6) este stabilită Kohlrausch și numit legea mișcării ion independente.
Limitarea mobilității ionice depinde numai de natura solventului și a temperaturii; mulți ioni, această valoare este determinată experimental și este dată în referințele.
Conductivitatea electrică molara de soluții de electroliți slabi mai putin puternice. Acest lucru se datorează faptului că, chiar și la concentrații scăzute, gradul de disociere a electroliților slabi este mică ( 1), prin urmare, în ciuda faptului că volumul soluției cuprins între electrozii, electrolitul conține 1 mol, transportori ion curent în acest volum este mai mic decât soluția de electrolit puternic. Cresterea molare de conductivitate electrică electrolitii slab asupra soluțiilor de diluție a fost asociată cu o creștere a gradului de disociere.
Din ecuațiile (4) și (5):
unde
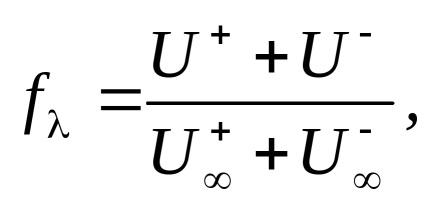
Viteza absolută a mișcării de ioni în soluții diluate de electrolit (U +. U-), și într-un infinit diluată (U + . U-) apropiate unul de altul (
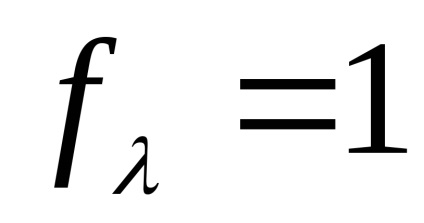
Astfel, gradul de disociere al soluției de electrolit la o concentrație dată poate fi calculată prin măsurarea conductibilității electrice molară a soluției și să știe . care poate fi calculat cu formula (5).