4 Be. 2s 2 → Be *. 2s 1 2p 1
Avand doi electroni nepereche, atom de beriliu capabil să formeze două conexiuni la mecanismul de schimb.
Conexiunea rezultată trebuie să fie diferit în energie deoarece electronii sunt la diferite subnivele. Cu toate acestea, s-a dovedit experimental că cele două sunt exact aceeași conexiune. Prin urmare, formarea de legături chimice este o aliniere a orbitalii atomice de energie și formă. Acest proces se numește - hibridizare. și „aliniate“ orbitali sunt numite hibrid.
hibridizarea cazul uneia dintre orbitalii și P- numit S- un sp-hibridizare.
Pentru sp-hibridizare tipic liniar structura moleculei, unghiul de valență 180 ° hibridizare .tak observată în grupul elementelor II.
De exemplu: BeCl2 clorură de beriliu moleculă - atom de beriliu pentru a forma legături cu doi atomi de clor într-o stare excitată (așa cum este arătat mai sus). Ca rezultat, norii de electroni s - (cote sferice) și p-electron (având opt cote volum) sunt supuse sp hibridizare, rezultând doi nori hibrizi sunt formate, care sunt situate în spațiul 180 0:
La fiecare dintre cei doi atomi de clor hibridizare nu are loc, deoarece nu mai este necesar un electron nepereche (deoarece electronul este situat pe p-subnivelul, forma norului său de electroni - volum opt) pentru formarea unei legături cu beriliu:
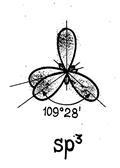
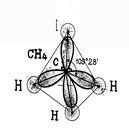
Astfel, prevederile de bază ale teoriei hibridizării:
1. Orbitele de hibridizare implicate diferite subnivele de același nivel.
2. Numărul de orbitali hibride este egal cu numărul de orbitali pure implicate în hibridizare.
3. Orbitele hibride mai alungite în direcția formării legăturilor chimice și, prin urmare, oferă o mai bună suprapunere a norilor de electroni.
Pagina generata pentru: 0,008 sec.