Această existență de izomeri având aceeași compoziție și procedura de compuși atomi dar diferă în natura atomilor sau grupelor de atomi în spațiu în raport cu celălalt.
Acest tip de izomerie descris Louis Pasteur (1848), J. van't Hoff, Le Bel (1874).
În condiții reale în sine și părțile sale individuale (atomi, grupuri de atomi) într-o stare de vibrație moleculă - mișcare de rotație și această mișcare este puternic alterează aranjamentul reciproc al atomilor din moleculă. În acest moment, întinderea legăturilor chimice și obligațiuni unghiuri schimbare și deci există diverse configurații și conformații ale moleculelor.
Prin urmare, izomerii spațiale sunt împărțite în două tipuri: conformația și configurare.
Configurare - este ordinea dispunerea atomilor din diferențele de spațiu excluzând, care apar ca urmare a rotației în jurul legăturilor simple. Acești izomeri există în diferite conformații.
Conformații - forme dinamice foarte instabile ale aceleiași molecule, care apar în atomii de rotație reztsltate sau grupuri de atomi în jurul simple legături, atomii care cauzează ocupă o poziție spațială diferită. Fiecare conformație a moleculei este caracterizată printr-o configurație particulară.
Ϭ-Link permite rotația în jurul acestuia, astfel încât o singură moleculă poate avea mai multe conformații. Dintre multele conformații sunt luate în considerare numai șase, pentru că pentru unghiul minim de rotație este considerat egal cu unghiul de 60 °. Se numește unghi de torsiune.
Deosebim: conformație eclipsat și frânată.
Zaslononnaya conformație apare în cazul în care aceiași substituenți situate la o distanță minimă față de altul și între ele sunt forțele de repulsie reciprocă și molecula ar trebui să aibă o rezervă mare de energie pentru a menține această conformație. Această conformație este nefavorabil energetic.
conformație inhibate - apare, dacă aceiași substituenți posibil departe unul de altul, iar molecula are un minim de energie. Această conformație este energetic favorabil.
Primul compus, care este cunoscută existența izomeri conformaționali este etan. Structura sa în spațiul unei perspective prin formula sau formula Newman:
Proiecție Formula Newman.
Cel mai aproape de noi punct desemnat de atomi de carbon în centrul cercului, cercul arată un atom de carbon de la distanță. Trei conectarea fiecărui atom reprezentat în formă de linii radiale din centrul cercului - pentru emisii reduse de carbon și mici - pentru atomul de carbon la distanță.
lanțuri de carbon Vdlinu se pot roti în jurul neskolkihS - obligațiuni C. Prin urmare, întregul circuit poate lua o varietate de forme geometrice. Prin raze X datele de difracție de hidrocarburi saturate cu catenă lungă și cu gheare au o conformație în zig-zag. De exemplu: palmitic (C15 H31 COOH) și acid stearic (C17 H35 COOH) în conformații zigzag sunt parte a lipidelor membranei celulare și moleculele în monozaharide solutii ia conformație cu gheare.
.
Conformații ale compușilor ciclici
Pentru compușii ciclici caracterizate prin stresul unghiular asociat cu prezența unei bucle închise.
Dacă vă numărați ciclurile de plat, pentru multe dintre aceste unghiuri de obligațiuni se va abate în mod semnificativ de la normal. Abaterea de tensiune cauzată de legătura unghiurilor între atomii de carbon din ciclul valorii normale sau unghiular numit Bayer.
De exemplu, în carbon ciclohexan atomii sunt sp3 - stare hibrid și, respectiv unghiul de valență 109 ar trebui să fie egală cu aproximativ 28 /. Dacă atomii de carbon se află într-un plan, ciclul unghiuri plane de legătură internă ar fi egală cu 120. și toți atomii ar vodorodanahodilis în conformație Eclipsați. Cu toate acestea, ciclohexan nu poate fi plat datorită prezenței tensiunilor unghiulare și torsiune puternic. Se produce conformație nonplanar mai puțin obositoare datorită rotației parțiale în jurul ϭ obligațiuni, printre care sunt mai stabile scaun conformație Ivan.
Conformația mai energic favorabil al unui scaun, deoarece îi lipsesc acoperit atomii poziția de carbon și hidrogen. Locația tuturor atomilor H de la același atom de C, ca în conformația inhibată de etan. În această conformație toți atomii de hidrogen sunt deschise și disponibile pentru reacție.
conformație baie mai puțin energic favorabilă, deoarece cele două perechi de atomi de C (C-2 și C-3), (C-5 și C-6), situată în partea de jos, atomii de H sunt conformație zaslononnoy, astfel încât această conformație are rezerve mari de energie și instabilă.
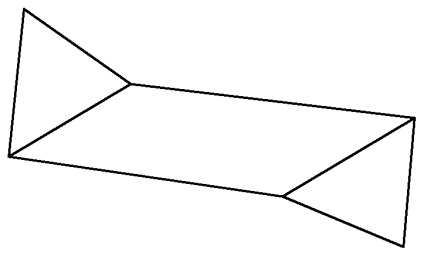
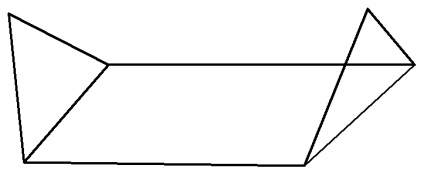
O formă de „scaun“ este mai energic favorabil decât „baie“.
La sfârșitul secolului al XIX-lea a fost descoperit că mulți compuși organici pot roti planul fascicul polarizat la stânga și la dreapta. E. Incidentul fascicul de lumină pe molecula interactioneaza cu cochilii sale de electroni, polarizarea electronilor are loc, ceea ce duce la o schimbare în direcția de oscilație a câmpului electric. Dacă substanța rotește planul de oscilație în sensul acelor de ceasornic, se numește dextrogir (+) în cazul în care contra-sensul acelor de ceasornic - levogir (-). Aceste substanțe au fost identificate izomeri optici. izomerii optic activi conțin atom de carbon asimetric (chiral) - purtător de atom patru substituenți diferiți. Un alt factor important este lipsa de tot felul de simetrie (axa planului). Acestea includ multe dintre acizii hidroxi și amino
Studiile au arătat că astfel de compuși sunt caracterizați prin secvența de aranjarea substituenților pe atomii de carbon într-un sp3 - hibridizare.
Cel mai simplu este compus din acid lactic (2-hidroxipropanoic)
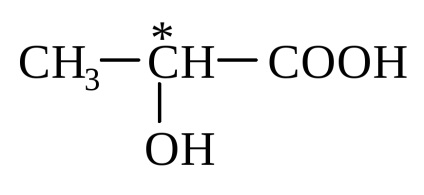
Acești compuși aparțin reciproc, cum ar fi mâna stângă și dreaptă
Stereoizomeri ale căror molecule sunt unul de altul ca un obiect, și este în contradicție cu ea o imagine în oglindă sau mâna stânga și dreapta sunt numite enantiomeri (izomeri optici, enantiomerii, Antipodes și fenomenul se numește enantiomeri ai tuturor proprietăților chimice și fizice ale enantiomerilor sunt identice cu excepția a două lucruri. Rotația planului lumina polarizată (în polarimeter instrumentului) și activitatea biologică.
Configurația absolută a moleculelor determină complexe metode fizico-chimice.
Configurația relativă a compușilor optic activi a fost determinată prin comparație cu un standard de glyceraldehyde. substanțe optic active având o configurație dextrogiră sau glyceraldehyde levogir (M. Rozanov 1906), substanțe numite D- și L-series. amestec egal de izomeri dextro- și levorotatori ai compușilor numit un racemat și un punct de vedere optic inactiv.
Studiile au aratat ca semn luminos de rotație nu poate fi asociat cu calitatea de membru vesch Insulele la D- și L-serie, acesta este definit numai experimental în dispozitive - polarimetre. De exemplu, L-lactic-ta este de aproximativ +3,8 unghiul de rotație. D- lactic-ta - 3,8 despre.
Enantiomerii ilustrat prin utilizarea formulelor Fischer.
Lanțul de carbon este reprezentat printr-o linie verticală.
In partea de sus este plasat grup funcțional senior la partea de jos cei mai tineri.
Atomul de carbon asimetric reprezentat de linia orizontală pe care capetele sunt substituenți.
Numărul de izomeri sunt definiți prin formula 2 n. n - numărul de atomi de carbon asimetrici.

Printre enantiomerii pot fi molecule simetrice având nici o activitate optică, și sunt numite izomerul mezo.
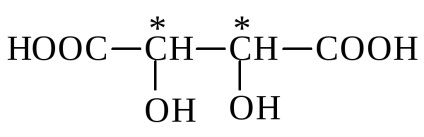
Racemat - struguri-ta
izomeri optici care nu sunt izomeri oglindă configurație mai multe, dar nu diferă toți atomii de carbon asimetrici având diferite fizice și chimice de legare-te-numit zâmbind -di specificat stereoizomer.
-diastereomeri (izomeri geometrici) - stereoizomeri ai ea având în molecula -bond. Acestea se găsesc în alchenele, carboxilic nesaturat superior la-t, dicarboxilic nesaturat a-ton. De exemplu:
Activitatea biologică în organică vesch asociată cu structura lor. De exemplu:
Cis-butendioic la-unu trans-butendioic la-unu
maleic-ta - fumaric-ta - nu este toxic,
extrem de toxice conținute în organism
Toate naturale nesaturate de carbon mai mare la tine sunt izomeri cis.