Fig.1. Modelul unei singure legături covalente (densitatea de electroni este evidențiată în roșu)
Legătură covalentă (lat co -. «Împreună“ și Văi - «cu forța") - o legătură chimică. suprapunere format (socializare) a perechii de nori de valență de electroni. Furnizarea de nori de comunicații de electroni (electroni) sunt numite pereche de electroni totală.
Termenul „legătură covalentă“ a fost introdus pentru prima dată de laureat al Premiului Nobel Irving Langmuir în 1919. Acest termen se referă la legarea chimică. datorită proprietății comune asupra electronilor. Spre deosebire de obligațiuni metalice. în care electronii sunt liberi sau prin legături ionice. în care unul dintre atomii donori de electroni și devin un cation. și un alt atom accepta electroni și să devină un anion.
Având în vedere probabilitatea de amplitudine M. Born Densitatea de probabilitate de a găsi electronii de legătură este concentrată în spațiul dintre nucleele moleculei (figura 1). Teoria repulsie a perechilor de electroni sunt considerate dimensiunile geometrice ale acestor perechi. Astfel, pentru elementele fiecărei perioade există o anumită rază medie pereche de electroni (Â):
0.6 pentru elemente de până la neon; 0,75 pentru elementele de până la argon; 0,75 pentru elemente de până la kripton și 0,8 pentru elemente de până la xenon.
Proprietățile caracteristice ale legăturii covalente - focus, saturația, polaritatea, polarizabilitatea - determină proprietățile fizice ale compușilor chimice și.
Orientarea comunicării datorită structurii moleculare a substanței și forma geometrică a moleculei. Unghiurile dintre cele două legături sunt numite valență.
Saturation - capacitatea unui număr limitat de atomi pentru a forma legături covalente. Numărul de legături formate de un atom, este limitat la orbitalii atomici exterioare.
Polaritatea conexiunii datorită distribuției inegale a densității de electroni, datorită diferenței de atomi electronegative. Pe această bază legături covalente subdivizat în nepolar și polar (nepolare - molecula diatomica este format din aceiași atomi (H2 Cl2 N2) și norii de electroni din fiecare atom sunt distribuite simetric în raport cu acești atomi .. Polar - molecula diatomica este format din atomi de diferite elemente chimice, și totalul electron nor se îndreaptă către unul dintre atomii, formând astfel o distribuție asimetrică a sarcinilor electrice în moleculă, generând momentul de dipol al moleculei).
Comunicarea polarizabilitatea exprimată în deplasarea electronilor sub influența unui câmp electric extern, inclusiv alte particule reactive. Polarizabilitatea mobilității electronilor este determinată. Polaritatea și polarizabilitatea de legături covalente determină reactivitatea moleculelor asupra reactivilor polari.
Cei mai mulți electroni de telefonie mobilă, cu atât mai departe ele sunt de nucleu.
Cu toate acestea, de două ori câștigător Pauling Nobel a subliniat că „în unele molecule sunt legături covalente datorate unuia sau trei perechi de electroni în loc de general.“ legare chimică Un electron este realizat într-un ion molecular de hidrogen, H2 +.
Hidrogenul molecular H2 + ionul cuprinde doi protoni si un electron. Singurul sistem de electroni molecular compensează între repulsia electrostatică doi protoni și le menține la o distanță de 1,06 Â (lungimea legăturii H2 +). Centrul densității de electroni a norului de electroni a sistemului molecular echidistant față de cei doi protoni pe Bohr raza α0 = 0,53 A, si este centrul de simetrie al ionului molecular de hidrogen, H2 +.
Legătura covalentă este formată dintr-o pereche de electroni, împărțită între doi atomi, iar acești electroni trebuie să ocupe două orbitali stabile, unul din fiecare atom.
Ca rezultat, electronii formează nivelul de energie socializare umplut. Bond se formează, în cazul în care energia totală la acest nivel va fi mai mică decât în starea inițială (și diferența de energie nu este mai mult decât energia de legare).
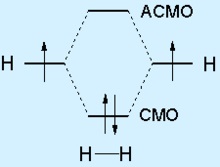
Umplerea electronii atomici (la margini) și (centru) orbitalii moleculare în molecula H2. Axa verticală indică nivelul de energie al electronilor indicate prin săgeți care le reflectă înapoi.
Conform teoriei orbitalilor moleculare se suprapun două Orbitali rezultate atomice în cel mai simplu caz la formarea a două moleculare orbitale (MO), care leagă MO și antibonding (antibonding) MO. electroni socializate dispuse la o energie mai scăzută a legării MO.
Lipirea în atomii de recombinare Editare
Atomii și radicalii liberi tind să se recombine - formarea unei legături covalente prin socializare doi electroni nepereche aparținând particulelor diferite.
formarea legăturii recombinare este însoțită de eliberarea de energie. Astfel, reacția atomilor de hidrogen într-o cantitate de energie eliberată 436 kJ / mol. Acest efect este utilizat în domeniu, cu sudarea hidrogenului atomic. Fluxul de hidrogen este trecut printr-un arc electric, care este generat de fluxul de atomi de hidrogen. Atomii apoi recombinate pe o suprafață metalică a fost plasată o mică distanță de arc. Metalul poate fi în acest mod este încălzit peste 3500 ° C, Marele avantaj al „flacără de hidrogen atomic“ este uniformitatea încălzirii, permițând sudarea unei piese de metal foarte subțire.
Cu toate acestea, mecanismul de interacțiune interatomică a rămas mult timp necunoscut. Numai în 1930, F. Londra a introdus conceptul de atracție dispersie - interacțiunea dintre dipoli instantanee și induse (induse). În prezent, forța de atracție cauzată de interacțiunea dintre fluctuante dipole atomii și moleculele electrice sunt numite „forțele din Londra.“
Energia acestei interacțiuni, este direct proporțională cu pătratul oc polarizabilitatea electronice și invers proporțională cu distanța dintre doi atomi sau molecule în al șaselea grad.
formarea legăturii de donor-acceptor mecanism Edit
De asemenea, sa subliniat în mecanismul de formare a secțiunii omogene legături covalente anterioare, există un mecanism eterogen - interacțiunea dintre ioni încărcați oppositely - H + proton și hidrogen negativ ion H -. numit ion hidrură:
Când se apropie nor doi electroni de ioni (pereche de electroni) ion hidrură a unui proton este tras și în cele din urmă devine comun ambelor nuclee de hidrogen, adică transformați în pereche de electroni de legare. Particulele furnizate de o pereche de electroni, numit donator, iar particula care primesc perechea de electroni este numit acceptor. Acest mecanism de formare a legăturii covalente se numește donor-acceptor.
Distribuția densității de electroni între nucleele de molecule de hidrogen este aceeași, indiferent de mecanismul, așa numita o legătură obținută printr-un mecanism donor-acceptor, o legătură donor-acceptor corespunzător.
Ca donator al unei perechi de electroni, cu excepția unui compus de ioni hidrură acționează elemente principale de grup V-VII grupe ale sistemului periodic al elementelor într-un grad mai mic de oxidare a elementului. Deci, mai Yohannes, Bronsted a constatat că protonul nu există liber sub formă de soluție în apă, se formează oxoniu cation:
Proton atacă perechea de electroni unshared a moleculei de apă și formează un cation stabil existent în soluții apoase de acizi.
In mod similar se produce proton care unește molecula de amoniac pentru a forma un cation complex de amoniu:
În acest mod (pe mecanismul donor-acceptor care formează o legătură covalentă) sunt preparați o clasă mare de compuși oniu. care cuprinde amoniu. oxoniu, fosfoniu, sulfoniu și alți compuși.
Ca donor de electroni pereche poate fi o moleculă de hidrogen, care la contactul cu rezultatele de protoni în formarea de ioni de hidrogen H3 molecular +:
Legarea de electroni pereche hidrogen H3 ion molecular + aparține simultan celor trei protoni.
Tipuri de lipire covalentă Editare
Există trei tipuri de legătură chimică covalentă, altele decât mecanismul de formare:
1. o singură legătură covalentă. Pentru formarea sa fiecare atom furnizează un electron nepereche. În formarea unei singure legături covalente invinuite ale atomilor rămân neschimbate.
- Dacă atomii, care formează o legătură covalentă, sunt aceleași, atunci adevăratele acuzații ale atomilor în moleculă sunt, de asemenea, la fel ca și atomii care formează legătura, este la fel de competenți pereche de electroni socializat. O astfel de legătură se numește legătură covalentă nepolară. Aceste comunicări sunt substanțe simple. de exemplu: O N 2. 2. 2. Cl nu numai un singur tip de nemetale pot forma o legătură covalentă nepolară. Legătură covalentă poate forma un non-polari, metaloizi și elemente, dintre care electronegativitatea este de o importanță egală, de exemplu, în molecula de legătură PH3 covalentă este un non-polar, deoarece hidrogenul este EO EO fosfor.
- Dacă atomii sunt diferite, gradul de proprietate pereche de electroni socializat determinat prin diferența atomilor electronegative. Atom cu o mai mare electronegativitate mai puternic atrage o pereche de electroni, iar puterea sa adevărată devine negativă. Atom cu electronegativitate inferior dobândește, respectiv, aceeași magnitudine de sarcină pozitivă. În cazul în care se formează o legătură între cele două nemetale diferite. că o astfel de conexiune este numită o legătură covalentă polară.
2. Legăturile donor-acceptor. Pentru formarea acestui tip de legătură covalentă, ambii electroni oferă unul dintre atomii - donatorului. Al doilea dintre atomii implicați în formarea de legături, numită acceptor. Taxa formală rezultată a moleculei donator este incrementat, iar taxa oficială a acceptorul este decrementat.
3. semipolară legătura. Acesta poate fi privit ca o legătură donor-acceptor polar. Acest tip de o legătură covalentă se formează între un atom având o pereche de electroni unshared (azot. Fosfor. Sulf. Halogeni și m. P.) și atomul cu doi electroni nepereche (oxigen. Sulf). formarea legăturii semi-polar are loc în două etape:
1. Transferul unui electron din perechea de electroni unshared atomului la un atom cu doi electroni nepereche. Ca rezultat, un atom cu o pereche de electroni unshared este convertit la cation radicalul (particule încărcate pozitiv cu un electron nepereche) și atomul cu doi electroni nepereche - un anion radical (particule încărcate negativ cu un electron nepereche). 2. socializarea electroni nepereche (ca în cazul unei legături covalente simplă).
În formarea unui atom de legătură semipolar cu o pereche de electroni unshared mărește taxa formală pe unitate, iar atomul cu doi electroni nepereche reduce sarcina lor formală pe unitate.
Sigma (σ) -. pi (π) -bond - o descriere aproximativă a tipurilor de legături covalente în moleculele de compuși diferiți, σ-bond este caracterizat prin aceea că densitatea norului de electroni este maximă de-a lungul axei care unește nucleele atomilor. In formarea π -bond efectuat așa-numita suprapunere laterală a norilor de electroni, iar densitatea norului de electroni este maximal „mai sus“ și „jos“, planul σ-legătura. De exemplu, luați etilena. acetilenă și benzen.
Etilen molecula C2 H4 are o legătură dublă CH2 = CH2. formula electronică: H: C :: C: H. Miezuri de atomi de etilenă sunt coplanare. Trei nori de electroni din fiecare atom de carbon care formează trei legături covalente la alți atomi în același plan (cu unghiul dintre ele aproximativ 120 °). Cloud atom de carbon al patrulea al unui electron de valență situate deasupra și dedesubtul planului moleculei. Astfel de nori de electroni ambii atomi de carbon se suprapun parțial deasupra și sub planul moleculei, formează o a doua legătură între atomii de carbon. În primul rând, o legătură covalentă puternică între atomii de carbon se numește σ-legătură; în al doilea rând, mai puțin puternică legătură covalentă se numește π-obligațiuni.
Molecula liniară de acetilenă
Este sigma legături între atomii de carbon și hidrogen, un σ-legătură între doi atomi de carbon și doi π -bond între atomii de carbon. Două π -bond situate deasupra domeniului de aplicare al sigma obligațiuni în două planuri reciproc perpendiculare.
Toti cei sase atomi de carbon, benzen moleculă ciclică C6 H6 într-un singur plan minciună. Între atomii de carbon din planul inelului sunt σ-legătură; aceeași comunicare sunt la fiecare atom de carbon cu atomi de hidrogen. În implementarea acestor conexiuni atomi de carbon petrece trei electroni. Norii patra electroni de valență ale atomilor de carbon având optari formă situate perpendicular pe planul moleculei de benzen. Fiecare astfel de nor se suprapune cu norii de electroni aceiași atomi de carbon adiacenți. Molecula de benzen nu sunt formate trei -bond π separat și un singur π este sistemul de electroni al celor șase electroni comune tuturor atomilor de carbon. Legătură între atomii de carbon din molecula de benzen complet identice.
Exemple de substanțe cu o legătură covalentă Edit
O simplă legătură covalentă atomii legat în moleculele de gaz simplu (H2. Cl2 și colab.) Și compușii (H2O, NH3. CH4. CO2. HCl și colab.). Compușii cu o legătură donor-acceptor - amoniu NH4 +. tetrafluorborat anion BF4 - și alți compuși cu o legătură semipolar -. protoxidul de azot N2 O, O - -PCl3 +.
Cristale legătură covalentă - izolatori sau semiconductori. Exemple tipice de cristale atomice (atomii care sunt interconectate prin legături covalente (atomice)) poate servi ca un diamant. germaniu și siliciu.
- I. Langmuir. Journal of American Chemical Society. - 1919. - V. 41. - 868 cu.
- ↑ L.Pauling. Natura legăturii chimice. - Leningrad Literatura Editura chimică, 1947. - S. 16-440.
- Gillespie F. Geometria moleculelor. - M: "Mir", 1975. - S. 49-278.
- Poling.L. Pauling AP Chimie. - "Mir", 1978. - S. 129-684 cu.
- Nekrasov BV Curs de chimie generală. - 14 - M. Ed. literatura chimică, 1962. - P. 110 - 976 s.
- Daniels F. R. Alberti Chimie Fizică. - M., "Mir", 1978. - S. 453-646.
- N. S. Ahmetov chimie anorganică. - ed. A 2-rev. și ext. - M. Școala Superioară, 1975. - S. 60 - 672 secunde.
- Chimice dicționar enciclopedic / Ch. Ed. I. L. Knunyants. - M. bufnițe. Encyclopedia, 1983. - S. 132-792 cu.
- Oniu Compuși IUPAC aur de carte
- „Dicționarul Enciclopedic de Chimie“ M. „Enciclopedia sovietică“, 1983, p.264.