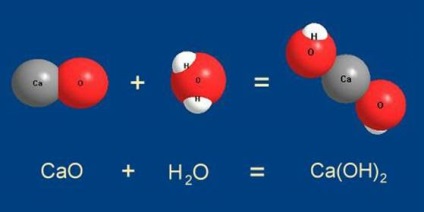
În secțiunile anterioare am fost convenabil să ia în considerare reactanți și produse sub formă de molecule individuale. Am constatat că destul de CaO per moleculă pentru o reacție completă de a lua de asemenea, o moleculă de H2O:
Pentru reacția metanului cu oxigenul pentru fiecare moleculă de metan trebuie să ia două molecule de oxigen:
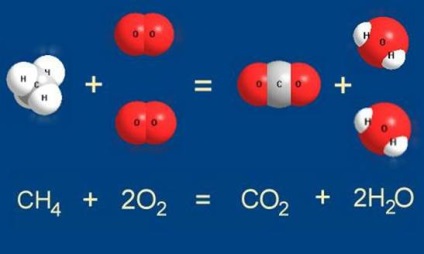
Aerul conține întotdeauna suficient oxigen pentru reacția de ardere metan are loc exact așa cum este scris:
Dar imaginați-vă pentru un moment că trebuie să construim un arzător cu gaz pentru munca subacvatice sau de a conduce o navă spațială. Aceste dispozitive trebuie să funcționeze fără a avea acces aer. De aceea, în astfel de construcții face fără un calcul precis al moleculelor reactivilor care intră în zona de ardere (adică, o reacție chimică).
De exemplu, în cazul în care spațiul în camera de ardere a motorului scade mai multe molecule de combustibil decât poate reacționa cu un agent de oxidare, acest lucru duce la o reducere împingere a motorului și o pierdere de o parte prețioasă a combustibilului.
Dar, mai întâi, să ne ia nici o reacție „spațiu“, dar ceva mai simplu. Să presupunem că știm că substanțele A și B reacționează unul cu celălalt pentru a forma un produs B. Cu alte cuvinte, știm ecuația reacției chimice:
Un exemplu ar fi, ne-am întâlnit deja o reacție simplă:
Rămâne să ia cantitatea dorită A (CaO) și B (H2O) și pentru a efectua reacția. Deci, cât de mult trebuie să cântărească cât de mult A și B. că reacția a avut loc până la sfârșitul anului și fără materii prime din stânga?
Dacă luăm aceeași greutate a probelor A și B. Scopul REACH - produsul B este sigur de a fi contaminate cu una dintre materiile prime. De ce se întâmplă acest lucru?
Faptul că A și B - două molecule diferite și diferite greutate. Acest lucru înseamnă că în 1 g de substanță A - un număr de molecule, și 1 g de compus B - numărul de molecule diferite. În reacția dintre ele vor molecule neapărat necheltuite unuia dintre materiile prime.
Pentru a lucra chimiști convenabil pentru a lua substanțe astfel de porțiuni. care ar conține același număr de molecule. Să presupunem chimist a luat parte CaO, care conține N molecule ale substanței. Apoi, o anumită parte din apă este luată în care aceleași N molecule. Amestecarea acestor două porțiuni reactivi chimistul primește porțiunea de produs, care va fi, de asemenea exact N molecule de Ca (OH) 2:
După terminarea reacției nu va mai fi CaO sau H2O, deoarece porțiuni de reactivi conținute același număr de molecule - prin N piese.
Este ușor să conta un anumit număr de mere, bomboane sau monede, dar molecula este dificil de a conta.
Dar acest lucru se poate face prin cântărirea materiei. Să presupunem că știm că N molecule se cântărește de M este de ajuns să cântărească pe scalele M g de substanță pentru a fi siguri că ne-am masurat N molecule ale substanței. Dar de unde știi valoarea M în grame?
Masa moleculară constă din masa atomilor constituente. Elementele de masă atomică relativă (greutate atomică) putem învăța din tabelul periodic. greutate atomică Ca - 40 amu și greutatea atomică a oxigenului - 16 AMU Prin urmare, greutatea moleculară (greutate moleculară) a moleculei CaO este:
40 amu (Ca) + 16 amu (O) = 56 amu (CaO)
Să presupunem că am decis să ia la reacția 10 molecule de CaO și 10 molecule de H 2 O. Este convenabil dacă vom lucra cu astfel de cantități mici de substanță? Bineînțeles că nu.
Apoi, încercați să cântărească în balanța de un milion (1000000) de molecule din fiecare reactant. În principiu, este posibil să se calculeze bucată de greutate cât de mult de un milion de molecule de CaO. Știm că 1 uam = 1,67. 10 -27 kg (această valoare am întâlnit în tabelul 2-1 din capitolul 2).
Să ne întoarcem la comoditatea de kilograme la grame. Greutatea 1 gram amu este: 1.67. 10 -24 g nu este greu să se multiplice această valoare cu 56 (numărul din molecula AMU CaO).
Obținem: 56. (1.67. 10 -24 g) = 93,5. 10 -24 g Acum se înmulțește greutatea unei molecule de numărul de molecule de ele însele (ppm). Obținem greutatea (în grame), care deservesc un milion de molecule de CaO:
93.5. 10 -24 g × 1,000,000 = 93,5 x 10 -18 g
Dacă ne amintim că cea mai mare acuratețe solzii de laborator convenționale de 1 mg (este de doar 10 -3 g), se constată că un milion de molecule de CaO - destul de incomod „porțiune“ molecule pentru cântărirea pe cântar.
Deci, trebuie să alegem să lucreze nu un milion de molecule, și alte câteva, porțiune mai convenabil N molecule. Aparent, acest număr N trebuie să fie mult mai mult de un milion de molecule.
** Încercați să găsiți un număr de molecule (N), cu care ar fi convenabil de a lucra cu. Acest lucru poate să nu fie în mod necesar exact numărul de molecule de CaO sau H2 O. Numărul N trebuie să fie astfel încât, cu ajutorul ei a fost convenabil să „măsură“ orice molecule de cântărire, atomi și particule, în general, a căror greutate este foarte mică (măsurată în unități atomice de masă).
Ia-una din aceste particule - protonul. Ea are o masă de 1 AMU (Rounded). Aceeași masă are un neutron.
Să calculăm cât de mulți protoni (sau neutroni) vor fi în 1 g de particule. Pentru a face acest lucru, intocmim o proporție:
1 particulă de cântărire 1 amu - cântărește 1,67. 10 -24 g
N particule - cantaresc 1 g
Se pare, este foarte convenabil de servire de la 6 x 23 particule octombrie (molecule, atomi, ioni, etc.). Am nota cu litera N (a se distinge de orice alte porțiuni ale N). Dacă N este egal cu numărul total al particulelor (x 23 octombrie 6), greutatea lor în grame numeric egal cu greutatea acestor particule în uam
Cu alte cuvinte, pentru a merge la unități amu la grame, suficientă pentru a crește scala de măsurare 6. Octombrie 23 de ori!
Numărul N = 6. 23 octombrie este ca un factor de conversie de amu la scară scara de grame. De exemplu, greutatea moleculară a CaO este 56 amu Cântare la 56 g de oxid de calciu CaO, am astfel „numărat“ 6. 23 octombrie molecule de CaO. Pentru acum „ceasul“ pentru reacția noastră este exact același număr de molecule de H2O, trebuie cântărite pe cântare exact 18 g apă:
1 + 1 uam (masa atomica doi H) + 16 amu (Greutatea unui atom de O) = 18 amu (H2O)
Este clar că, cântărește 18 grame de apă, avem nevoie de astfel 6. 23 octombrie
Aproximativ 2, se amestecă porțiuni de molecule în care numărul de molecule de CaO și H2 O ai exact la fel. Astfel, noi oferim o reacție completă. Produsul de reacție - Ca (OH) 2 - ar trebui să rămână molecule nereacționați CaO și H2O
Aceste porțiuni 6. 23 octombrie unități de substanțe (atomi, molecule, ioni) sunt un mol de substanță. Astfel, molia - o măsură a cantității de substanță. A nu rotunjit cantitate mai precisă, a particulelor de substanță în 1 mol de 6.022045. 23 octombrie particule. Până la a doua zecimală (6.02. 23 octombrie), această valoare trebuie să ne amintim bine.
MOLE - este cantitatea de substanță egală cu 6,02. 23 octombrie unități structurale ale substanței -