Conceptul de hidroliză
Hidroliza - o reacție chimică în interacțiunea unei substanțe (săruri anorganice, proteine, aminoacizi, hidrați de carbon și alte substanțe organice naturale.) Cu apa.
Dacă luăm în considerare hidroliza sărurilor, medii și acide sărurile de hidroliză expuse, în formarea care implică puternic acid și bază slabă (FeSO4. ZnCl2), un acid slab și o bază puternică (NaCO3. CaSO3), acid slab și slab bazic ((NH4) 2 CO3 . BeSiO3). Dacă sarea se obține prin reacția unui acid tare și o bază (NaCl, K2 SO4) reacția de hidroliză nu procedează.
tipuri de hidroliză
Există mai multe tipuri de hidroliză, printre care cele mai importante sunt:
a) hidroliza anion
Acest tip de hidroliză este caracteristic numai săruri organice și anorganice în formarea care implică un acid slab și o bază tare, de exemplu, prin anion metasilicat hidrolizat de sodiu (Na2 SiO3), formiat de sodiu (HCOONa), acetat de potasiu (CH3 COOK), sulfit de calciu (CaSO3 ) etc.
Luați în considerare mai în detaliu prin exemplul de acetat de potasiu (CH3 COOK). Această sare formată dintr-o bază tare - hidroxid de potasiu (KOH) și un acid slab - acetic (CH3COOH). Ecuația de hidroliză este după cum urmează:
CH3 COOK ↔ CH3 COO - + K + (sare de disociere);
CH3 COO - + K + + H2O ↔ CH3COOH + K + + OH - (ecuația ionică totală);
CH3 COO - + H2O ↔ CH3COOH + OH - (prescurtat ecuația ionic);
CH3 COOK + H2 O↔ CH3COOH + KOH (ecuația moleculară).
Prezența ionilor OH - în soluție alcalină indică natura mediului.
b) hidroliza cationului
Acest tip de hidroliză este caracteristic numai a sărurilor anorganice în formarea care implică puternic acide și a unei baze slabe, de exemplu, prin hidroliza cation clorurii de fier (III) (FeCl3), sulfat de cupru (II) (CuSO4), nitrat, beriliu (Be (NO3) 2) etc.
Luați în considerare mai în detaliu în exemplul nitrat, beriliu (Be (NO3) 2). Această sare bază slabă formată - hidroxid de beriliu (Be (OH) 2) și un acid puternic - azotic (HNO3). Ecuația de hidroliză este după cum urmează:
Be (NO3) 2 ↔ Be 2+ + 2NO3 - (sare de disociere);
Be 2+ + 2NO3 - + H2O ↔ BeOH + + H + + 2NO3 - (ecuația ionică totală);
Fii 2+ + H2O ↔ BeOH + + H + (prescurtat ecuația ionic);
Teoretic este posibil a doua etapă de hidroliză:
Be (OH) NO3 ↔ BeOH + + NO3 - (sare de disociere);
BeOH + + NO3 - + H2O ↔ Be (OH) 2 + H + + NO3 - (ecuația ionică totală);
BeOH + + H2O ↔ Be (OH) 2 + H + (ecuația ionică prescurtată);
Prezența ionilor H + indică natura acidă a mediului.
c) hidroliză și cation și anion
Acest tip de hidroliză este caracteristic numai pentru săruri anorganice și organice, care a implicat formarea unui acid slab și o bază slabă. De exemplu, cation și anion hidrolizează sulfit de amoniu (NH4 SO3), sulfat de fier (II) (FeS), nitrit, cupru (II) (Cu (NO2) 2), etc.
Luați în considerare mai în detaliu exemplul sulfura de sulf. Această sare bază slabă formată - hidroxid de fier (II) (Fe (OH) 2) și un acid slab - hidrogen sulfurat (H2S). Ecuația de hidroliză este după cum urmează:
FeS ↔ Fe 2+ + S 2- (sare de disociere);
FeS - + H2O ↔ Fe (OH) 2 ↓ + H2 S ↑ (ecuația moleculară).
d) hidroliza bazică
Acest tip de hidroliză este caracteristic numai soedineniy.Veschestvo organic hidrolizat prin acțiunea alcalii. Luați în considerare mai în detaliu în exemplul halogenat:
d) hidroliza acidă
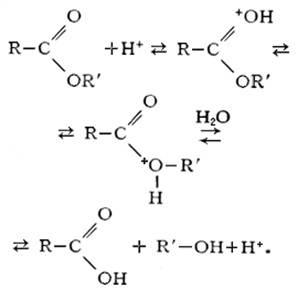
Acest tip de hidroliză este caracteristic numai compușilor organici. Substanța este hidrolizat în prezența acizilor minerali puternici (de obicei clorhidric - HCl și sulfuric-H2 SO4). Luați în considerare mai în detaliu în exemplele de esteri:
e) hidroliza enzimatică a
Un astfel de tip este supus biopolimeri de hidroliză, cum ar fi proteine și carbohidrați: la una din etapele de mai clivaj hidroliza rapidă a compușilor cu masa moleculară înaltă în amestecul de reacție este introdus enzime (enzime).
Exemple de rezolvare a problemelor
Sare de nitrat de zinc (Zn (NO3) 2) este format dintr-o bază slabă - hidroxid de zinc și un acid tare - azotic. Este hidrolizat de cation. Numărul ecuația 3.
Sol sulfură de magneziu (MGS) este format dintr-o bază tare - hidroxid de magneziu și un acid slab - hidrogen sulfurat. Este hidrolizat de anionul. Numărul ecuația 4.
Sol acetat de amoniu (CH3 COONH4) este format dintr-o bază slabă - hidroxid de amoniu și un acid slab - acetic. Un proces de hidroliza cationi și anioni. Numărul ecuația 2.
sare de litiu nitrit (LiNO2) este format dintr-o bază tare - hidroxid de litiu și un acid slab - azotos. Este hidrolizat de anionul. Numărul ecuația 1.
Care dintre următoarele săruri sunt hidrolizate de cationi și anioni? Justificați răspunsul.
Dintre sărurile de mai sus, hidroliza cationi și anioni sunt supuse fosfat de zinc, sulfit, carbonat, beriliu și de aluminiu, ca aceste săruri sunt formate de acizi slabi si baze:
Zn3 (PO4) 2 - Acid ortofosforic slab (H3 PO4), hidroxid de zinc slab bazic (Zn (OH) 2).
BeCO3 - acid slab carbonic (CO3 H2), slab hidroxid de beriliu bază (Be (OH) 2).
AI2 (SO3) 3 - acid slab sulfuros (SO3 H2), slab hidroxid de bază din aluminiu (Al (OH) 3).