Moleculele constau din doi atomi de halogen.
Odată cu creșterea culorii în masă atomică devine mai întunecat, crescând punctele de topire și de fierbere și densitatea.
Fluorul este produs prin electroliza unei topituri de KHF2 fluorhidrat de potasiu (HF se descompune):
Anod: 2F - - → F2 2e
În industrie, în principal, clorul produs prin electroliza unei soluții apoase de clorură de sodiu:
In laborator clor obținut prin acțiunea diferitelor oxidanți pentru acid clorhidric:
preparat în mod similar brom și iod, oxidarea HBr, HI, sau săruri ale acestora:
Proprietățile chimice ale F2
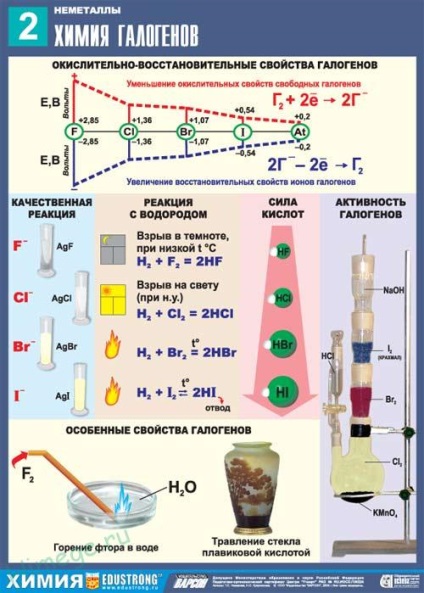
Toți halogeni prezintă o activitate ridicată de oxidare, care scade în trecerea de la fluor la iod.
Fluor - cel mai activ dintre halogeni, reacționează cu toate metalele, fără excepție, multe dintre ele într-o atmosferă de fluor se aprind spontan, eliberând cantități mari de căldură:
Fără încălzire fluor reacționează cu multe nemetale (H2 S, C, Si, P.) - toate reacțiile puternic exoterme în care:
Când fluoro încălzit oxidează toate celelalte halogeni (starea lor de oxidare +1)
Când fluorul iradiat reacționează chiar și cu gaze inerte (nobile):
Interacțiunea fluorului cu substanțe complexe are loc, de asemenea, foarte viguros:
Proprietăți chimice CI2
clor reacționează cu toate substanțele simple cu excepția oxigen, azot și gaze nobile:
Reacția de substituție a hidrocarburilor și de adaos:
Clor capabil la încălzire brom sau iod stramuta a compușilor cu hidrogen sau metale:
reacționează cu apa în mod reversibil:
Cl2 + H2 O↔ HCI + HClO (apă de clor)
2NaON + Cl2 → NaCl + H2O + NaSlO (rece)
ZSl2 6KON + → + 5KSl KClO3 ZN2 + O (atunci când este încălzit).
Conform bromo activitatea chimică ocupă o poziție intermediară între clor și iod. Interacționează cu multe substante simple de:
Bromo, precum clorul, dizolvat în apă și, parțial, reacția cu ea, formează așa-numita „apa bromul“:
Când dizolvat în soluții alcaline la rece se formează bromură și hipobromit
2NaOH + Br2 = NaBr + NaBrO + H2O
La temperaturi ridicate (100 ° C) - bromură și bromat:
Bromul prin reacția cu soluții de iodură de iod liber este eliberat:
Br2 + 2Împărați = I2 + 2KBr.
Deoarece substanțele organice care au o legătură dublă sau triplă. Decolorarea apei brom - răspuns de calitate la compusul nesaturat:
C2 H4 + Br2 = C2 H4 Br2.
Iodul semnificativ diferit în reactivitate de celelalte halogeni. Ea nu reacționează cu majoritatea nemetale, și metal reacționează lent numai atunci când este încălzit.
Interacțiunea iod cu hidrogen are loc numai sub încălzire puternică, reacția este puternic endotermă și reversibil:
Iodul este practic insolubil în apă și nu este capabil să oxideze chiar și atunci când este încălzit; Din acest motiv, nu există nici o „apă de iod.“
Cu toate acestea, iod este capabil să se dizolve în soluții de ioduri pentru a forma un anion complex:
Soluția rezultată se numește soluție Lugol.
hidrogen sulfurat H2S, tiosulfat de sodiu Na2 S2 O3 și alte reducere pentru al restaura I -:
Clor și alți oxidanți puternici, se transformă într-o soluție apoasă în IO3 -:
Adsorbit pe pete de amidon de iod în albastru de reacție de culoare închisă de culoare de calitate la iod.
Astfel, halogenul activitate chimică lic scade succesiv de fluor la iod. Fiecare halo printre F - I pot deplasa după expandarea compușii săi cu hidrogen sau un metal, adică, fiecare halogen ca substanță simplă este capabil să oxideze ionul halogenură cu oricare dintre următoarele halogeni.