Motive - electroliti, numai ionii OH sunt formate prin disociere de la care ionii negativi -.
Fe (OH) 2 ↔ Fe 2+ + 2OH -;
Toate bazele sunt clasificate în organice și anorganice (pentru baze organice includ amine - derivați de amoniac în care atomii de hidrogen sunt substituiți cu radicali hidrocarbonați (R-NH2) aminele cu formula generală (limitarea) CnH2n + 3 N ..), care au de asemenea propria lor (intern) de clasificare.
În condiții normale, o cantitate semnificativă de baze anorganice există în stare solidă, unele amorf (Cu (OH) 2).
Bazele organice metilamina, dimetilamina și trimetilamina - gaze, membru mediu al seriei alifatice - lichide, superioare - solide. aminele inferioare sunt ușor solubile în apă și au un miros înțepător.
Bazele formule chimice
Formulele chimice Bazele considera exemplul câțiva reprezentanți (atât anorganici și organici): -NaOH hidroxid de sodiu, hidroxid de cupru (II) - Cu (OH) 2 imetilamine - CH3 NH2. Formula chimică prezintă compoziția calitativă și cantitativă a moleculei (numărul și tipul de atomi incluși în compusul specific) Conform formulei chimice poate fi calculat acizi cu greutate moleculară (Ar (H) = 1 amu Ar (Na) = 23a.e.m. Ar (Cu) = 64a.e.m. Ar (O) = 16 amu Ar (N) = 14 amu Ar (C) = 12 uam):
Dl (NaOH) = Ar (Na) + Ar (O) + Ar (H);
Dl (NaOH) = + 16 + 23 1 = 40.
Dl (Cu (OH) 2) = Ar (Cu) + 2 x Ar (H) + 2 x Ar (O);
Dl (Cu (OH) 2) = 64 + 2 x 1 + 2 x = 64 + 16 2 + 32 = 98.
Dl (CH3 NH2) = 12 x + 1 + 5 14 = 12 + 5 + 14 = 34.
Structura (grafice) Bazele formula
Structură (grafic) substanță formulă este mai intuitiv. Ea arată modul în care atomii sunt conectate unul la celălalt în interiorul moleculei. Noi subliniem formula structurală a fiecăruia dintre compușii de mai sus:
Fig. 1. Formula structurală de hidroxid de sodiu.
Fig. 2. Formula structurală hidroxid de cupru (II).
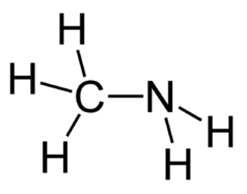
Fig. 3. Formula structurală este metilamină.
formula ionica
Toate bază sunt electroliți anorganici, adică se pot disocia în ioni în soluție apoasă:
NaOH ↔ Na + + OH -;
Cu (OH) 2 ↔ Cu 2+ + 2OH -.
Exemple de rezolvare a problemelor
Prin limitarea neutralizanți 25,5 g exces de acid monobazic a fost alocat 5.6 l (STP) de gaz cu soluție de carbonat acid de sodiu. Determina formula moleculară a acidului.
Ecuația neutralizare limitare monoacid cu exces de soluție de carbonat de sodiu într-o formă generală:
Se calculează cantitatea de substanță eliberată în timpul reacției de dioxid de carbon:
n (CO2) = 5,6 / 22,4 = 0,25 mol.
Se calculează masa molară limitare de acid monobazic:
Definim numărul de atomi de carbon în molecula de limitare de acid monobazic (valori ale maselor atomice relative luate din Mendeleev Tabelul periodic sunt rotunjite la întregi: 12 - pentru carbon 1 - 16 pentru hidrogen și oxigen):
M (CnH2n + 1 COOH) = 12n + 2n 1 + 12 + + 16 + 16 + 1 = 14n + 46;
14n + 46 = 102 g / mol;
Aceasta înseamnă că formula moleculară limitare acidul monobazic C4 H9 COOH.