O eroare este detectată pe o pagină, selectați-l și apăsați pe Ctrl + Enter
Surse chimice. intrare
Solidul (și lichid) atom de metal legătură legat de metal. Acesta poate fi descris ca o formă simplificată. atomii de metal dau electronii de valență în spațiul interatomică - așa-numitul banda de conducție. Ca rezultat, în rețeaua cristalină ionii metalici sunt înconjurate de „gaz de electroni“ - electroni de valență, care au devenit comune pentru toți atomii. Electronii (aproape) să circule liber în spațiul interatomică, care, în special datorită conductivitate termică și electrică bună a metalelor, maleabilitatea și luciu metalic.
Dacă placa metalică inferioară în apă, o parte a cationilor trec în soluție, electronii rămân. Ca urmare, metalul va fi încărcat negativ și soluția - pozitivă. excesul de electroni se adună în apropierea suprafeței cationilor metalici - lângă suprafața soluției: un strat dublu electric. Cu cât este mai activă a metalului, cu atât mai mare cationi în soluție și suprafața metalică mai încărcată negativ.
Valoarea absolută a diferenței dintre potențialele dintre metal și soluția nu este posibilă măsurarea, dar se poate măsura diferența de potențial relativă - între cele două metale diferite cufundate într-o soluție. Deoarece diferența de potențial dintre metal și soluția depinde nu numai activitatea chimică a metalului, dar și asupra concentrației cationului în concentrația soluției trebuie să fie standardizate. În acest scop, metalul este cufundat într-o soluție de sare cu concentrația cation metalic de 1 mol / l.
Acum combina două din metal conductor electric (de exemplu, sârmă), pe care se va deplasa electronii. Navele combinate cu soluții de sare „electrolitica în punte“. pod electrolitica - un tub cu o soluție de clorură de potasiu [1] (sau alt electrolit - figură prezintă sulfat de sodiu), pe care se va deplasa ionii (în soluție de clorură de potasiu nu curgea, în locul soluției este mai bine să ia clorură de potasiu gel, de exemplu, agar).
Când ne-am conecta conductorul electric și ionic, un curent va curge în sistem: electronii se vor deplasa dintr-un metal care este încărcat mai mult negativ, metalul care este încărcat mai pozitiv. Simultan tubul cu clorura de potasiu se va muta ioni. Între metale voltmetru poate fi setat, definind astfel o diferență de potențial.
Iată cum arată pentru zinc și cupru.
Într-o soluție de zinc încărcat mai negativă decât cuprul. Ca rezultat, electronii se vor deplasa din placa de zinc la cupru. Pe o suprafață de cupru, acești electroni vor fi conectate cu cationii de cupru din soluție (cupru depus pe electrod), în timp ce cationii de zinc se va muta de pe suprafața metalică în soluție. Anionii (de exemplu, sulfat), care au fost într-un vas cu o soluție de sare de cupru, se va deplasa de-a lungul podului într-un vas electrolitic cu sare de zinc - pentru a compensa excesul de cationi în vasul (cationi metalici de zinc merge din soluție și cantitatea acestora în crește soluție).
Astfel, într-un curent electric flux de sistem: electronii se va muta de zinc la cupru, și anionii sulfat se va muta în afara vasului cu o soluție de sulfat de cupru într-un vas cu o soluție de sulfat de zinc. Curent va curge atâta timp cât toate zincul nu se dizolvă sau toți cationii de cupru din soluție pentru recuperarea cuprului metalic [1].
Zn 0 => Zn 2+ + 2e -
Cu 2+ + 2e - = Cu 0
Un astfel de dispozitiv este numit celula electrochimică. Principiul de mai sus este baza tuturor surselor chimice de alimentare (HIT) - baterii, baterii reîncărcabile, pile de combustie.
Reacțiile de construcție și chimice care stau la baza funcționării surselor de energie chimică, pot fi foarte diferite, dar principiul este același:
la un electrod este oxidat la celălalt - recuperarea. In primul caz, ioni sau molecule neutre dona electroni la electrodul, al doilea - electronii Rob de electrod: rezultat între electrozii un debitul curentului electric.
În cazul în care electrozii sunt compuse din două metale diferite (cupru și zinc, de exemplu), nu este în mod necesar trebuie să fie imersate în soluții de sare ale acestor metale (cupru și zinc) pot fi, de exemplu, să ia soluția acidă și imersate în aceasta placa de cupru și zinc . Mai mult, doi electrozi metalici adesea nu sunt în vase separate, și în aceeași (adică, ele sunt înconjurate de una și aceeași soluție). Important la această soluție cationii electronilor luate din suprafața plăcii de cupru, care sprijină această dizolvare de zinc și, prin urmare - și curentul electric în sistem (în acest caz, cationul de hidrogen de acid este un cation).
Zn 0 => Zn 2+ + 2e -
2H + + 2e - = H2 0
Ambii electrozi pot fi realizate din același metal (de exemplu, cupru), dar există în două soluții de sare (sulfat de cupru) cu diferite concentrații de cationi. - Aceasta este, de asemenea, un curent de celule galvanice va curge (așa-numitul element de concentrare).
Cu 0 => Cu 2+ + 2e - (unde concentrația mai mică de cupru în soluție)
Cu 2+ + 2e - = Cu 0 (în cazul în care este mai mare concentrația de cupru în soluție)
__________________________________________________
1 Strict vorbind, curentul electric va curge până echilibrul în sistem până când potențialul celor doi electrozi nu sunt egale. Ca dizolvarea concentrației de zinc cationului în creșterile de soluție - rezultând un potențial de zinc devine mai puțin negativă (în raport cu cupru) precum și depunerea cuprului dintr-o concentrație a soluției de cationi în scăderile de soluție și potențialul de cupru este mai puțin pozitiv (pentru zinc) . Teoretic trebuie să vină un moment în care nu se redizolvă zinc și cupru - pentru a precipita din soluție - ca diferența de potențial devine zero (dar nu și de timpul tot zincul s-a dizolvat și nu toate cuprul rezolvă din soluție). În practică, concentrația cation de cupru la care se oprește din cupru precipită din soluție și zinc - nu se redizolvă foarte, foarte scăzut - poate fi adesea neglijate.
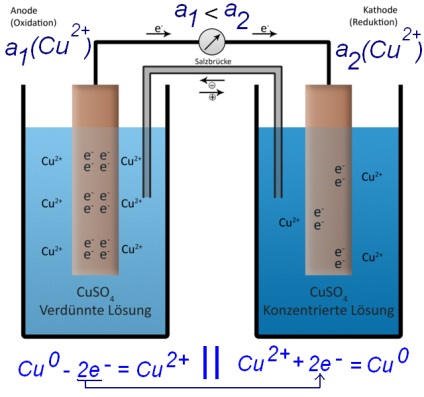
Element de concentrare (în concentrație pahar mai mare de ioni de cupru în stânga - inferior)
În unele cazuri, cei doi electrozi și o soluție la fel, de exemplu, într-un acumulator de plumb. Plăci de plumb acoperite cu sulfat de plumb și cufundat în acid sulfuric diluat. Curent nu curge între ele, așa cum și plăci și soluția sunt aceleași. Cu toate acestea, în timpul curent de încărcare a bateriei este conectat: la unul plăci electrodul pozitiv, celălalt - negativ. Ca rezultat, pozitiv electrod de plumb PbSO4 sulfat oxidat la bioxid de PbO2. sulfatul de plumb negativ este redus la Pb metalic. Bateria este încărcată și gata de plecare. Când electrozii sunt conectate conductor, curge un curent între acestea: un electrod este oxidat pentru a conduce sulfat și dă electroni la celălalt electrod dioxidul de plumb acceptă electroni și este redusă pentru a conduce sulfat.
Când toate plumb oxidat la un electrod și dioxid de plumb la celălalt electrod este restabilită (în ambele cazuri - să conducă sulfat), și descărcat curentul bateriei nu mai curge. Dar, spre deosebire de baterii, bateria este că acesta poate fi descărcat de multe ori, și apoi din nou evacuate. Principiul de funcționare al bateriei poate fi diferită, dar caracteristica principală este că acestea pot fi reîncărcate. Bateriile bune pot rezista la mii de cicluri de încărcare-descărcare de gestiune.

acumulator plumb (deschis)
Element de cupru galvanic - zinc - acid sulfuric
Turnat într-un pahar de laborator de acid sulfuric diluat, aceasta a redus placă de oțel galvanizat. evoluția hidrogenului a început. La o placă atașat de sârmă „crocodil“, conectat cu un alt crocodil cu tub de cupru aplatizate. Muiată cupru în sticlă cu zinc și acid - suprafața de cupru cu evoluția hidrogenului a început.
Am obtinut celula electrochimică: zincul se dizolva, electronii trec prin fir la suprafața de cupru din cupru sunt evacuate (restaurate) ioni de hidrogen. In mod ideal, după imersia în degajarea de hidrogen din cupru de acid la suprafața de zinc ar trebui încheiată, dar hidrogenul real și a stat pe cupru și zinc.
În cazul în care placa de zinc îndepărtate din acid, dar să plece de cupru, cu degajarea de hidrogen a încetat cupru suprafață de cupru nu deplasează hidrogen din acidul sulfuric.
Conectate între electrozii plăcilor tester - tensiune avansat 0,8-0,9 V. Dacă îndepărtați una dintre plăcile (cupru și zinc) din soluția - tensiunea scade la zero (fără curent electric în sistem). Același lucru se întâmplă în cazul în care zincul și cuprul din soluția să vină în contact: electronii se va muta de zinc la cupru direct - fără a trece prin sârmă și testerul.
Cum se poate mări tensiunea celulei noastre? Răspunsul ne, dacă luăm în considerare ecuațiile proceselor:
Zn 0 => Zn 2+ + 2e -
2H + + 2e - = H2 0
Forța electromotoare (emf) a celulei este egală cu diferența de potențial de electrod, în cazul nostru - „hidrogen“ [2] și zinc:
E = emf (2H + / H2) - E (Zn 2+ / Zn)
Capacitatea mai mare a electrodului de hidrogen și inferior - zinc, mai mare celula EMF. În ambele cazuri, potențiale de electrod - hidrogen sau zinc crește odată cu creșterea concentrației cationilor de hidrogen sau zinc în soluție, respectiv.
Două ieșire: pentru a reduce concentrația de ioni de zinc, sau pentru creșterea concentrației de ioni de hidrogen.
La momentul inițial al concentrației cationilor de zinc este practic zero (reducerea ei nicăieri), dar este posibil să se crească concentrația cationilor de hidrogen - se adaugă acid sulfuric mai mult de sticlă. Potențialul electrodului de hidrogen va crește ca urmare a potențialelor creșteri de diferență.
rafinament imediat semnificative: prin operarea celulei electrochimice ca concentrația ionilor de hidrogen în soluție va scădea și ioni de zinc - creșterea (zinc trece în soluție și ionii de hidrogen sunt reduși la H2). Concluzie: EMF nostru a celulei va cădea în cele din urmă.
O altă opțiune - înlocui orice metal de zinc, care este în zinc din stânga serie tensiune electrochimică (adică la metal, este mai activ decât zincul). Potențialul de electrod cu un metal pozitiv (ceteris paribus). De exemplu, se poate lua de magneziu în loc de zinc.
Ce se va schimba în cazul în care în loc să luăm alte cupru - metale mai puțin activă (care, în seria electrochimică este corect Cu), de exemplu - de argint, platină, etc. Potențialul de a crește celula? Nu, pentru că nu avem de-a face cu celula electrochimică cu electrozi de zinc și cupru (alias element de Daniel):
și electroplacate cu un element de zinc și electrozi de hidrogen.
Este ușor de observat că materialul electrodului la care este eliberat de hidrogen nu este inclusă în ecuație, și astfel nu are nici o valoare [3].
__________________________________________________
2 Termenul „electrod de hidrogen“ este în ghilimele, deoarece într-o placă standard de electrod de hidrogen nu este de cupru și platină - un impact semnificativ asupra muncii sale.
3 Strict vorbind, materialul de electrod la care este eliberat de hidrogen, este setat (chiar este). - Altfel, un electrod standard de hidrogen ar fi nevoie să se folosească de platină. Dar să nu complice prezentarea.