O2 se leaga de hemoglobina prin protomers Fe 2+. care este conectat la cele patru atomi de azot ai atomului de azot din ciclu pirol și subiectul
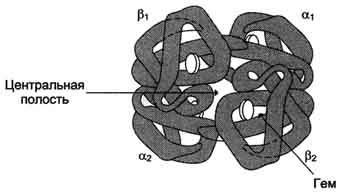
Fig. 1-32. Structura hemoglobinei.
proteina F8 Giese a protomer. legarea de Fe 2+ legătură rămasă liberă coordonare O2 apare pe cealaltă parte a planului hemului în Giese E7 (un mod similar așa cum apare în mioglobina). Giese E7 nu reacționează cu O2. dar oferă condiții optime pentru legarea sa (fig. 1-33).
In deoxyhemoglobin printr-o legătură covalentă la atomul parte proteină Fe 2+ reliefează din planul heme în direcția Gis F8. atom Aderarea O2 la Fe 2+ un protomer determină deplasarea ei în planul hemul, urmată de deplasarea reziduului Gis F8 și lanțul polipeptidic, în care aparține. Deoarece protomer este conectat cu celelalte protomers și proteinele posedă labilitate conformationala, o schimbare în conformația întregii proteine. modificări conformaționale în alte protomers, simplifica după aderare molecula O2. Aceasta cauzează nouă schimbare conformațională în proteina de legare și accelerare ca urmare a moleculei O2. A patra molecula O2 este atașat hemoglobina este de 300 de ori mai ușoară decât prima moleculă (fig. 1-34).
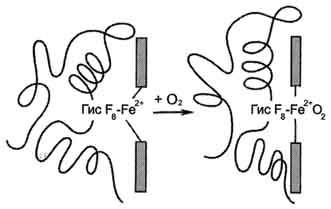
Fig. 1-33. Schimbarea prlozheniya Fe 2+ și porțiunea de proteină a hemoglobinei cu aderarea O2.
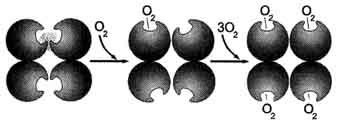
Fig. 1-34. modificări conformaționale Cooperative protomers hemoglobina la aderare O2.
modificare conformațională (și proprietăți deci funcționale) a tuturor protomers proteine oligomere sub ligand aderare la numai una dintre ele se numește cooperare modificări conformaționale protomers.
In mod similar de disociere tisulară Fiecare moleculă O2 modifică conformația protomers și facilitează scindarea ulterioară a moleculelor O2.
Curba de disociere O2 pentru mioglobina și hemoglobina
Cooperativity în protomers hemoglobinei pot fi observate în curbele de disociere a O2 pentru mioglobinei și hemoglobinei (Fig. 1-35).
raportul O2 ocupat locuri ale proteinei de legare la numărul total de site-uri capabile de legare, numit gradul de saturare a acestor proteine de oxigen. Curbele disocierii arată modul în care aceste proteine sunt saturate la diferite valori ale presiunii parțiale a oxigenului O2.
O2 curba de disociere pentru mioglobina are forma unei hiperbole simple. Acest lucru indică faptul că mioglobina se leagă reversibil la ligand, și nu este influențată de factori externi (diagrama de mai jos).
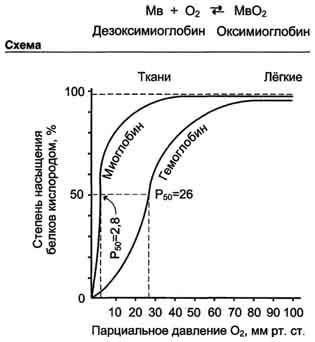
Fig. 1-35. Curbele de disociere oxigen pentru mioglobinei și hemoglobinei în funcție de presiunea parțială a oxigenului.
Procesele de formare și descompunere a oxymyoglobin sunt în echilibru, iar echilibrul deplasează spre stânga sau spre dreapta, în funcție de faptul dacă este adăugat sau scos din sistemul de oxigen. Mioglobina leagă oxigenul, în care capilarele țesuturilor eliberează hemoglobina și mioglobina se poate elibera O2 ca răspuns la o creștere a cererii pentru ea și țesutul muscular în timpul utilizării intensive a O2, ca urmare a efortului fizic.
Mioglobina are o afinitate foarte mare pentru O2. Chiar și la o presiune parțială de O2. egală cu 1-2 mm Hg. Art. Mioglobina rămâne asociat cu O2 la 50%.
Curba de disociere O2 pentru hemoglobină. Din graficul din fig. 1-35 arată că hemoglobina are o afinitate mult mai scăzută pentru D2; semisaturată O2 hemoglobina are loc la o presiune mai mare de O2 (circa 26 mm Hg. v.).
Curba de disociere pentru hemoglobină este forma sigmoid (formă de S). Acest lucru indică faptul că activitatea protomers hemoglobinei cooperativ: cele mai protomers O2 da, mai ușor merge molecule ulterioare de clivaj O2.
In repaus capilare musculare, în care presiunea de O2 este de aproximativ 40 mm Hg. Art. cea mai mare parte oxigenul este returnat ca parte a oxihemoglobină înapoi în plămâni. Când munca fizică O2 a presiunii capilare de mușchi scade la 10-20 mm Hg. Art. Este în această regiune (10 la 40 mm Hg. V.) Este „porțiune rece“ curbă în formă de S, unde proprietatea cea mai evidentă a protomers de muncă de cooperare.
Prin urmare, datorită structurii unice a fiecăreia dintre proteinele examinate este adaptat pentru a îndeplini funcția: mioglobina - atașarea O2. hemoglobina eliberată în celula de a acumula și de a elibera, în caz de urgență; hemoglobină - atașarea O2 în plămâni, în cazul în care acesta ajunge la 100% saturație și O2 pentru a da în capilarele țesuturilor în funcție de schimbările de presiune în acesta O2
4. Transfer H + și din țesuturile C02 la plamani
cu ajutorul hemoglobinei. efect Bohr
Oxidarea compușilor organici pentru a produce energie are loc în mitocondriile celulelor folosind O2. livrate de hemoglobina din plamani. Ca urmare a oxidării substanțelor produși de descompunere final - CO2 și H2O, numărul care este proporțională cu intensitatea proceselor de oxidare. CO2. format în țesuturi, este transportat în celule roșii din sânge. Acolo, sub acțiunea enzimei are loc karbangidrazy crește viteza de formare a H2 CO3. Acid carbonic slab poate disocia în HCO3- și H + -
Reacțiile Equilibrium în eritrocite, care sunt în capilarele țesuturilor, deplasat spre dreapta, așa cum rezultă din disocierea de protoni acid carbonic pot fi atașate la anumite porțiuni ale moleculei de hemoglobină: radicalii Gis146 -chains doi, radicali Gis122 grupa amino terminală și două -chains ???. Toate aceste șase porțiuni la hemoglobină de tranziție de la dezoxi hidroxi pentru a dobândi o afinitate mai mare pentru N + ca urmare a unei schimbări locale a mediului de aminoacizi din jurul acestor site-uri (apropiindu-le încărcat negativ grupările carboxil ale aminoacizilor).
Aderarea trei perechi de protoni pentru a hemoglobinei scade afinitatea pentru O2 și O2 îmbunătățește transportul în țesuturi care necesită aceasta (fig. 1-36, A). Creșterea eliberarea de O2 de hemoglobină în funcție de concentrația de H + este numit efectul Bohr (numit după fiziologul danez Christian Bohr, descoperit pentru prima data acest efect).
In capilarele pulmonare ridicate O2 rezultate presiunii parțiale în eliminarea oxigenarea hemoglobinei și 6 protoni. Reaction CO2 + H2O - H2 CO3 - H + + HCO3 - mutat din stânga, iar CO2 rezultat este eliberat în spațiul alveolar și îndepărtat din aerul expirat (Figura 1-36, B.). Prin urmare, molecula de hemoglobină în cursul evoluției a dobândit capacitatea de a percepe și de a reacționa la informațiile primite de la mediul înconjurător. Concentrația crescută de protoni în mediu reduce afinitatea O2 a hemoglobinei și îmbunătățește transportul acestuia în țesutul (fig. 1-37).
Cea mai mare parte CO2 este transportat în sânge sub formă de HCO bicarbonat 3 -. puțin
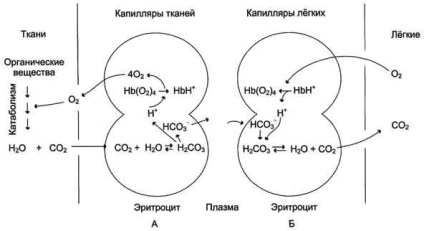
Fig. 1-36. Transferul de H + și CO2 din sânge. efect Bohr. A - Influența concentrației de H + și CO2 eliberarea O2 din complexul cu hemoglobina din tesutul (efectul Bohr); B - desoxyhemoglobin oxigenare in plamani, formarea și eliberarea de CO2.
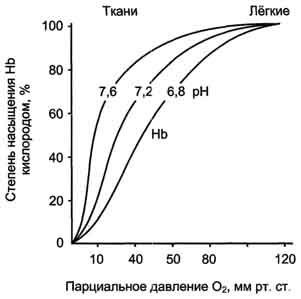
Fig. 1-37. Efectul pH-ului asupra curbei de disociere O2 pentru hemoglobină.
CO2 (aproximativ 15-20%) pot fi transferate în plămâni, care unește în mod reversibil terminalul non-ionizate? Gruparea amino. R-NH2 + CO2 = R-NH-COO + H +. rezultatul este un karbogemoglobin unde R - lanț polipeptidic de hemoglobină. Aderarea CO2 la hemoglobină și reduce afinitatea pentru O2.
5. 2,3-Bifosfoglitserat - allostertesky regulator de afinitate pentru hemoglobină O2
2,3-Bifosfoglitserat (BFG) - o substanță sintetizată în eritrocite din produsul intermediar de oxidare a glucozei 1,3-bifosfoglitserata.