Primul lucru pentru a înțelege că natura aproape orice lichid dizolvat sau o altă substanță. Fie că este vorba de apă dintr-o baltă, lac Baikal, citoplasma celulelor sau plasmă sanguină. Substanțele pot fi dizolvate într-o largă varietate, inclusiv sare. Fenomenul Osmoza apare atunci când cele două soluții cu concentrații diferite ale sărurilor sunt separate printr-o membrană semipermeabilă prin care un solvent poate trece (de exemplu, apă), dar nu poate trece soluți molecula.
Este important să fie distras de efectele imediate ale osmoză și de a înțelege acest termen ca presiunea osmotică. Definiția științifică este disponibilă pe wiki. Dar este important să se ocupe de acest fenomen la un nivel mai ușor de înțeles. În manual de fizică a arătat un foarte bun exemplu: dacă te arunci într-un pahar cu apă încrețită coaja, apoi, după un val în timp. În interiorul acestuia intră în apă (și molecule mici să treacă prin piele sunt stafide bine), precum și de zahăr și alte substanțe vor rămâne în interiorul fructului (moleculele lor sunt prea mari). Apa tinde să se egalizeze concentrația de săruri în interiorul și în afara, dar la un moment dat va veni o limită a capacității și a apei din interiorul are loc procesul să se oprească. Presiunea osmotică - presiunea care trebuie aplicată o soluție care să oprească curgerea apei în interior.
Să ne întoarcem la osmoză.
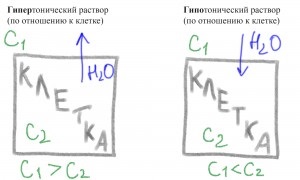
În cazul în care concentrația de sare în afara celulei este mai mare decât apa din interiorul va căuta din celula în jurul concentrației sale soluție diluată. Celula va pierde apa. O astfel de soluție se numește tonic hiper.
În cazul în care concentrația de sare este mai mică decât în exterior decât în interiorul celulei, apa tinde să fie spre interior, pentru a egaliza concentrația respectivei sare. Celula va fi umplut cu apă și poate exploda dacă nu este să ia măsuri active pentru a îndepărta apa. O astfel de soluție se numește tonic hipo.
În cazul în care concentrația de săruri și este în afara și în interiorul, va exista un schimb reciproc fără consecințe tragice reciproce. O astfel de soluție se numește iso tonic.
Se pare că osmoza - un proces de difuzie sided (flux de permeație) prin membrana semipermeabilă a moleculelor de solvent în direcția unei concentrații mai mari de substanță dizolvată volum cu o concentrație mai mică de solut.
patterns înțelegerea fenomenelor osmotice subiecte importante, cum ar fi primirea și circulația fluidelor într-o instalație, în special sistemele excretorii, de apă dulce și viața marină (și unicelular și multicelulare), utilizarea de soluție salină (în esență, izotonică) pentru injectare intravenoasă.
Pentru a înțelege importanța fenomenelor osmotice da un exemplu: concentrația sărurilor în soluția compoziției pentru injectare intramusculară trebuie să fie egală cu concentrația de sare în plasma sanguină (soluția fiziologică așa numita, adică, potrivit pentru fiziologia umană). Din punctul de vedere al acestor fenomene osmotice numita soluție izotonică. În general, după injectare, concentrația sărurilor în plasma sanguină nu se schimbă și activitatea celulelor continuă ca de obicei.
Dar dacă a apărut o eroare și soluția injectabilă este mai concentrată, apoi cele mai apropiate celule sanguine (după injectare și soluție de injecție) începe să curgă în apă cu plasmă ( „urmărind“ diluarea plasmei mai concentrată) și celule sanguine, de exemplu, eritrocitele vor pierde apă și zbârci. Și pierde funcționalitatea în consecință.
Dacă soluția injectabilă este mai concentrată decât plasma din sânge. Apa începe să curgă din celulele plasmatice din sânge, cum ar fi celulele rosii din sange, iar acestea se vor umfla și izbucni. Care este, de asemenea, afectează puternic funcția de țesut.