masa molara de etanol
alcool etilic (etanol) - substanță complexă de natură organică. Reprezentantul seriei omoloage de alcooli monohidroxilici.
Structura moleculei de benzen este prezentată în Fig. 1. În condiții normale este un lichid volatil incolor, cu miros caracteristic și gust de ardere. Amestecat cu apă și diferiți solvenți organici și, de asemenea, se dizolvă ușor multe substanțe (adesea de natură organică).
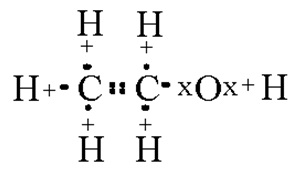
Fig. 1. Structura moleculelor de alcool etilic.
Formula moleculară a alcoolului etilic - C2 H5 OH. După cum se știe, greutatea moleculară a moleculei este suma maselor relative atomice ale atomilor cuprinzând molecula (valorile masei atomice relative luate din Mendeleev Tabelul periodic sunt rotunjite la întregi).
Dl (C2 H5 OH) = 2 x 6 + 12 x 16 = 1 + 24 + 6 + 16 = 46.
masa molara (M) - este greutatea 1 mol de substanță. Este ușor de a arăta că valorile numerice ale M masa molară și masa moleculară relativă Mr sunt egale, dar prima valoare are dimensiunea [M] = g / mol, și un al doilea adimensionale:
Aceasta înseamnă că masa molară a alcoolului etilic este de 46 g / mol.
Exemple de rezolvare a problemelor
Calculați ce masa de apă se obține dacă în reacție cu hidrogen a 16 g de oxigen?
Ecuația reacției hidrogenului cu oxigen interacțiune:
Calculăm compusul oxigen cu formula:
Pentru aceasta este necesar să se precizeze masa molară a oxigenului (valoarea atomică masa relativă preluată din Mendeleev Tabelul periodic, rotunjit la un număr întreg). După cum se cunoaște, masa molară a moleculei este suma maselor relative atomice ale atomilor din molecula (M = Mr):
M (O2) = 2 x Ar (O) = 2 x 16 = 32 g / mol.
Apoi, cantitatea de oxigen substanță va fi:
n (O2) = 16/32 = 0,5 mol.
Conform n ecuația reacției (O2): n (H2O) = 2. 2, atunci:
Am găsit masa molară a apei (presupus atunci când se calculează masa molară mai sus de oxigen și, într-adevăr, în acest caz):
M (H2O) = 2 x Ar (H) + Ar (O) = 2 x 1 + 16 = 2 = 18 +16 g / mol.
Definim un corp de apă:
m (H2O) = 0,5 x 16 = 8 g
Greutatea apei este de 8 g
Calculați ce volum de oxigen (STP) este necesar pentru oxid de sulf (VI) prin reacția cu oxid de sulf (IV) cântărind 6,4 g?
Ecuația reacției oxigenului cu oxid de sulf (IV), format ca rezultat al cărui oxid de sulf (VI):
Noi calcula cantitatea de substanță de oxid de sulf (IV), conform formulei:
Pentru aceasta este necesar să se specifice o masă molară de oxid de sulf (IV (masa atomică relativă preluată din Mendeleev Tabelul Periodic, rotunjit la un număr întreg). După cum se cunoaște, masa molară a moleculei este suma maselor relative atomice ale atomilor care cuprind molecula ( M = Mr):
M (SO2) = Ar (S) + 2 x Ar (O) = 32 + 2 x = 32 + 16 32 = 64 g / mol.
Apoi, cantitatea de substanță de oxid de sulf (IV va fi:
n (SO2) = 6,4 / 64 = 0,1 mol.
Conform n ecuația reacției (SO2): n (SO3) = 2. 2, atunci:
Am găsit masa molară a oxidului de sulf (VI) (ipoteză, oxigenul în calcularea masei molare și într-adevăr, în acest caz):
M (SO3) = Ar (S) + 3 x Ar (O) = 32 + 3 x 32 = + 16 48 = 80 g / mol.
Definiți greutatea oxidului de sulf (VI):
m (SO3) = 0,1 x 80 = 8 g