Proteine - polimerii macromoleculari naturali compuse din resturi de aminoacizi. conectate printr-o legătură peptidică; Ele reprezintă componenta principală a organismelor vii si baza moleculara a proceselor vitale.
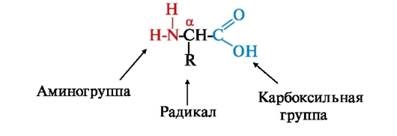
În natură, există mai mult de 300 de aminoacizi diferiți, dar numai 20 dintre ele sunt parte a proteinelor umane, animale și alte organisme superioare. Fiecare aminoacid are o grupare carboxil, o grupare amino în # 945 poziții (la atomul de carbon 2-a) și (catenă laterală) radical, în care la diferiți aminoacizi. La pH fiziologic (
7.4) o grupare carboxil a aminoacizilor este de obicei disociat și gruparea amino este protonată.
Toți aminoacizii (cu excepția glicinei) conțin un atom de carbon asimetric (de exemplu, un astfel de atom, patru legături de valență ale care sunt ocupate de diferiți substituenți, este numit hiralnyi centru ..), Și, prin urmare, pot exista ca L- și D-stereoizomeri (referință - glyceraldehyde ):
Pentru sinteza proteinelor umane sunt utilizate numai acizii L-amino. In proteine cu existență îndelungată de izomeri L pot dobândi lent D-configurație, aceasta fiind o caracteristică particulară a fiecărei vitezei de aminoacizi. Astfel, proteinele dentina dintelui conțin L-aspartat, care se desfășoară în D-formă, atunci când temperatura corpului la o rată de 0,01% pe an. Deoarece dentinei dinților cu greu schimbate și nu sintetizate la adulți în absența traumatismelor, conținutul de D-aspartat poate stabili vârsta unei persoane, care este utilizat în practica clinică și medico-legale.
Toate cele 20 de aminoacizi din corpul uman sunt diferite în structura, dimensiunea și radicali proprietăți fizico-chimice atașate la un # 945; atom de carbon.
Formula structurală 20 aminoacizi proteinogeni conduc, de obicei, la o masă proteinogenici așa-numitul aminoacizi:
Recent, folosind denumirile de o singură literă, mnemonice (a patra coloană) este folosit pentru stocarea lor pentru denumirile de aminoacizi.
Există diferite clasificări ale aminoacizilor. Una dintre ele se bazează pe caracteristica intensității radicalului cu apă partea interacțiune moleculară.
1. hidrofobă (nepolar) (Gly, Ala, Val, Leu, pro, nămol, trei, uscator de par).
2. hidrofil (polar):
a) neîncărcată (Ser, Thr, cis, ACH, Gin, tir * întâlnit *);
- încărcat negativ (Glu, Asp);
- încărcat pozitiv (Lys, Arg, GIS).
* Unele surse se referă la fotografiere Meth si aminoacizi hidrofobi.
substanțe hidrofile interacționează puternic cu moleculele de apă, ele conțin legături chimice polare. Hidrofobie, - o proprietate fizică a unei molecule care este „angajat“ pentru a evita contactul cu apa. molecule hidrofobi în general nepolară și „preferat“ să fie printre celelalte molecule neutre și solvenții nepolari. Hidrofilia și hydrophobicity sunt o manifestare a van der Waals (grup de interacțiuni slabe). Aceste interacțiuni definesc, în general, forțele responsabile pentru formarea structurii spațiale a macromoleculelor biologice. Structura spațială a apei tinde să deplaseze grupări hidrofobe încalcă o rețea de legături de hidrogen care implică molecule de apă. O astfel de ejectare din soluția apoasă și interacțiunea numită hidrofobă. Este cunoscut faptul că funcția biologică a biopolimerilor într-un mediu apos și că prezența unor legături hidrofobe, în mare măsură determină forma care achiziționează macromoleculei.
Este posibil să se clasifice aminoacizii din structura radicalului:
1. Alifatic (Gly, Ala, Val, Leu, Ile).
2. hidroxiamino acid (Ser, Thr).
3. bi (Asp, Glu).
4. amidele acizilor dicarboxilici (ACH, Gln).
5. conținând sulf (cis met).
6. ciclicitate (uscător de păr, tir, trei, GIS).
7. diaminomonocarboxylic (lys, arg).
8. iminoacizi (pro).
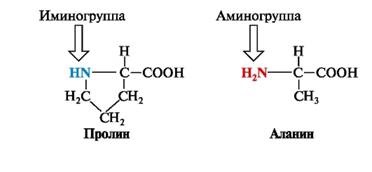
Structura proteinei umane are 19 aminoacizi și o imino ciclică - proline având o grupare imino -NH-. Rolul fragmentului hidrofob în această moleculă joacă catenă alifatică saturată de trei atomi de carbon formează un ciclu cu 5 atomi între # 945; atom de carbon și imino grup:
Unele proteine contin aminoacizi cu radical absent modificat in alte proteine. De exemplu, în lanțul polipeptidic de colagen includ hidroxilizina, elastină și colagen - hidroxiprolina. de coagulare a sângelui Factori protrombina, proconvertin, proteine osoase osteocalcina, sialoproteinei contin # 947; -karboksiglutaminovuyu Acid:
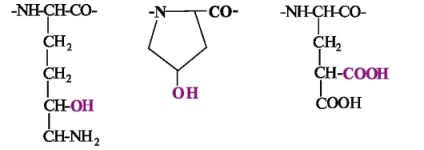
hidroxilizină hidroxiprolina # 947; Acid -Karboksiglutaminovaya
radicali amino modificare apare de obicei după încorporarea într-un lanț de polipeptidă, adică pe perioada postsynthetic.
Există o altă clasificare a aminoacizilor, în capacitatea organismului de a le sintetiza din precursori:
Esențial pentru valină umană, izoleucină, leucină, treonină, metionină, lizină, fenilalanină, triptofan, arginină (esențial pentru copii), histidină.
Interschimbabili pentru om: glicină, alanină, prolină, serină, cisteină, aspartat, asparagina, glutamat, glutamină, tirozină.
Mnemonic pentru amintindu-aminoacizi esențiali și neesențiali: