Noi vorbim despre ce este căldura de formare, precum și să definească condițiile pe care numitul standard. Pentru a rezolva această problemă, pentru a afla diferențele dintre substanțele simple și complexe. Pentru a consolida conceptul de „căldura de formare“, ia în considerare ecuația chimică specifică.

Entalpia standard a formării substanțelor
76 kJ de energie eliberată în reacția de carbon cu interacțiunea hidrogen gazos. În acest caz, cifra - un standard de entalpie de formare. Dar această căldură de formare de molecule de metan de la substanțe simple. „De ce?“ - Tu întrebi. Acest lucru se datorează faptului că componentele de pornire sunt carbon și hidrogen. 76 kJ / mol este energia pe care chimiștii numit „căldura de formare“.

Foi de date
In termochimic exista numeroase tabele care conțin căldura de formare a diferitelor substanțe chimice din substanțe simple. De exemplu, căldura de formare a substanței, formula care CO2. indicator are 393,5 kJ / mol în stare gazoasă.
importanță practică
De ce sunt valori de date? Căldura de formare - o valoare, care este utilizată în timpul calculării efectului termic al oricărui proces chimic. Pentru a efectua aceste calcule necesită utilizarea legii termochimie.

termochimie
Este o lege fundamentală care explică procesele energetice observate în cursul reacției chimice. În timpul interacțiunii observate schimbări calitative în sistemul reacționează. Unele substanțe dispar, componente noi apar în locul lor. Acest proces este însoțit de o schimbare în energia internă a sistemului, acesta este prezentat sub formă de muncă sau de căldură. Lucrarea, care este asociat cu extensia, pentru reacțiile chimice este cea mai mică cifră. Căldura eliberată în conversia unei componente într-o altă substanță poate fi o mare valoare.
Dacă luăm în considerare o varietate de transformări, aproape tot ce există absorbție sau eliberarea de o anumită cantitate de căldură. termochimie - o secțiune specială a fost creată pentru o explicație a fenomenelor.
Legea lui Hess
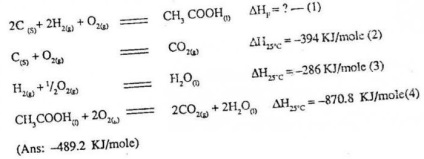
Datorită prima lege a termodinamicii, a devenit posibil să se efectueze calculul efectului termic în funcție de condițiile reacției chimice. calcule bazate pe legea termochimie principale, și anume legea Hess. Să formularea sa: transformarea efect chimic termică legată de natura, starea inițială și finală a materialului, acesta nu este asociată cu calea de interacțiune.
Ceea ce rezultă din această formulare? În cazul unui anumit produs nu trebuie să fie aplicat numai un exemplu de realizare a interacțiunii, reacția poate fi realizată în diferite moduri. În orice caz, indiferent de modul în care a da materialul dorit, efectul termic al procesului va rămâne neschimbat valoare. Pentru a defini este necesar să se rezume efectele termice ale transformărilor intermediare. Datorită legii Hess a devenit posibil să se efectueze calcule ale cantităților de efecte termice, este imposibil să se efectueze în calorimetru. De exemplu, pentru a cuantifica căldura de formare a substanțelor monoxid de carbon calculat prin legea lui Hess, dar prin experimente de rutină pentru a determina nu va reuși. Prin urmare, importante tabele termochimice speciale în care valorile numerice listate pentru diferite substanțe astfel cum sunt definite în condiții standard
puncte importante în calcul
Dat fiind faptul că căldura de formare - este căldura de reacție, de o importanță deosebită este starea de agregare a substanței în cauză. De exemplu, atunci când se iau măsurători este considerată a fi o stare standard grafit de carbon, în loc de diamant. De asemenea, să ia în considerare presiunea și temperatura, adică, condițiile în care este inițial în reacție componentelor. Aceste cantități fizice sunt în măsură să exercite o influență semnificativă asupra reacției, este crescută sau cantitatea de energie redus. Pentru a efectua calcule de bază în termochimie a decis să utilizeze indicatori concreți de presiune și temperatură.
condiții standard
Deoarece căldura de formare a materiei - o determinare a efectului energiei este în condiții standard, le distinge separat. Temperatura aleasă pentru calculul 298K presiune (25 grade Celsius) - 1 atmosferă. În plus, un punct important, care merită atenție este faptul că căldura de formare pentru orice substanțe simple, este zero. Acest lucru este logic, deoarece substanțele simple, nu se formează, adică, nu există nici un consum de energie pentru apariția lor.
elemente de termochimie
Această secțiune a chimiei moderne are o semnificație deosebită, deoarece aici efectuează calcule importante sunt rezultatele utilizate în producerea de energie termică. În termochimie, există mai mulți termeni și concepte care sunt importante pentru a opera pentru a obține rezultatele dorite. Entalpia (? H), indică faptul că o reacție chimică a avut loc într-un sistem închis, nu a existat nici un efect asupra răspunsului de la ceilalți reactanți, presiunea a fost constantă. Această clarificare vă permite să vorbim despre acuratețea calculelor efectuate.
În funcție de ce fel de reacție este considerat, mărimea și efectului termic rezultat poate varia semnificativ. Deci, pentru toate conversiile care implică descompunerea substanțelor complexe în mai multe componente simple se presupune absorbția de căldură. Conectarea unei multitudini de materiale de reacție de pornire într-un produs mai complex însoțită de eliberarea unor cantități substanțiale de energie.

concluzie
În rezolvarea oricărei probleme termochimice aplică același algoritm de acțiuni. În primul rând, în tabel se determină pentru fiecare componentă de pornire, precum și produși de reacție cantitatea de căldură de formare, fără a uita starea de agregare. În continuare, legea armate Hess echivaleaza pentru a determina cantitățile necunoscute.
O atenție deosebită trebuie acordată considerare factorii stereochimici existente înainte ca substanța inițială sau finală într-o anumită ecuație. Dacă reacția este substanțe simple căldura lor standard de formare este egal cu zero, adică astfel de componente nu au nici un efect asupra rezultatului obținut prin calcule. Încercați să utilizați informațiile privind o reacție specifică. Dacă luăm ca exemplu procesul de formare a oxidului de fier (Fe 3+) metal pur prin reacția cu grafit, valoarea de referință poate fi găsit căldurilor standard de formare. Pentru oxid de fier (Fe 3+) va fi -822.1 kJ / mol pentru grafit (substanță simplă) este zero. Reacția rezultată produce monoxid de carbon (CO), pentru care indicatorul are o valoare de - 110,5 kJ / mol, în timp ce căldura de formare eliberate de fier corespunde zero. Înregistrarea căldurilor standard de formare a acestei interacțiuni chimice se caracterizează după cum urmează:
δNo 298 = 3 x (-110,5) - (-822,1) = -331,5 + 822,1 = 490,6 kJ.
Analizând obținut prin lege Hess rezultat numeric, este posibil să se facă o concluzie logică că procesul este o conversie endotermă, adică presupune zatrachivaniya reacția de reducere a fierului energia oxidului său feric.