În cazul în care contractele de inima (sistola), sângele este expulzat din inimă și BO se extinde din arterele lor. Elasticitatea peretilor vaselor duce la faptul că, în timpul sistolei de sânge ejectat inima se întinde aorta, artere, deoarece accepta vase mari în timpul sistolei, mai mult sânge decât edemele la periferie.
presiune sistolica este normal uman 16 KPa. In timpul atenuarea inimii (diastola) întins dispar vasele de sânge și, prin urmare, energia potențială prin sânge este transformată în energie cinetică a fluxului sanguin, în timp ce presiunea diastolică este menținută egală cu 11KPa.
Valul puls - inmultire prin aorta si arterele val de creștere a presiunii cauzate de ejecția sângelui din ventriculul stâng în timpul sistolei.
Valul puls propagates cu o viteză de 5-10 m / s, de aceea, în timpul sistolei de 0,3 sec. aceasta ar trebui să se răspândească la 1,5-3m.
Fronde val de impuls atinge capătul înainte de căderea de presiune începe în aorta.

Ecuația armonică undei pulsului:
P0 - presiunea amplitudinii undei pulsului
X - distanța până la punctul de la derivatul surselor de oscilație
ω - frecvența circulară

E - modulul de elasticitate
Grosimea λ- pereților containerului
D - diametrul recipientului
termodinamică
Pornirea termodinamică - starea termodinamică a sistemului, caracterizat cantitățile fizice (volum, temperatură, presiune). În cazul în care parametrii de sistem în interacțiunea cu organele din jur nu se modifică în timp, acest sistem fix. Sistemul este astfel menținut gradiente constante ale unor parametri, la o viteză constantă poate curge reacție chimică.

În starea staționară a sistemului poate fi astfel încât un schimb de substanță cu mediul. Sistemul se numește închis în cazul în care bursele de energie. Un sistem izolat nu face schimb de materie cu împrejurimile. Parametrii de sistem nu se schimba cu timpul.
Cantitatea procesului de schimb de căldură de energie termică neurotransmisiei
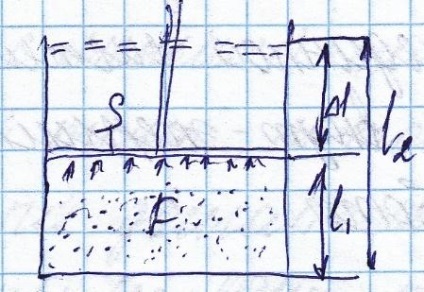
Calculăm activitatea elementară făcută de volumul elementar.
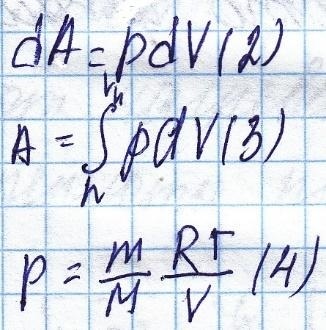

Prima lege a termodinamicii: cantitatea de căldură transferată către sistemul se va schimba în energie internă, și să execute lucrarea.
Sub energia internă se referă la cantitatea de energie potențială și cinetică.
Cantitatea de căldură și funcția de lucru a procesului, mai degrabă decât de stat.
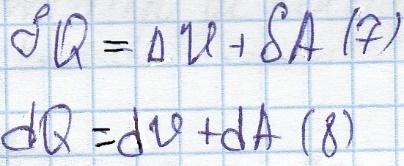
A doua lege a termodinamicii.
Primul principiu, este conservarea energiei, aceasta nu indică direcția proceselor de curgere. Prin schimb de căldură cu primul top la fel de posibil spontane de căldură de la cald la o raceala.
A doua lege a termodinamicii - căldură în sine nu se poate deplasa de la un organism de temperatură mai scăzută la o temperatură mai mare a corpului, astfel încât nu poate fi mișcare perpetuă, adică proces discontinuu singurul rezultat ar fi transformarea căldurii în muncă.
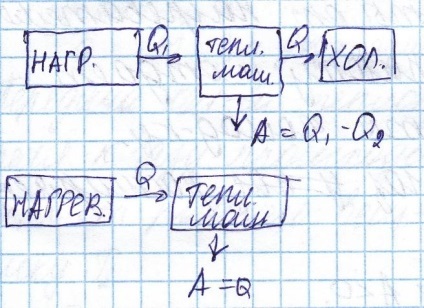
Lucrarea motorului termic se face în detrimentul căldurii primite de la sistemul de încălzire, dar căldura va trece o parte din frigider
Luați în considerare conceptul de a-și exprima legea termodinamicii
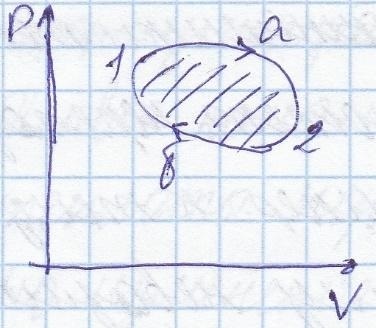
Proces 1-2 - numit reversibil dacă este posibil să se efectueze procesul invers 2-1.
Ciclul (proces ciclic) - un proces în care toate resetate. Acest ciclu se numește directă. Aceasta corespunde motorului termic, astfel cum dispozitiv care primește cantitatea de căldură din sistemul de încălzire funcționează și dă o parte din căldura frigiderului.
În timpul 1A-2, gazul se extinde. A> 00
În procesul de 2-B-1, A <0
Ciclul inversă corespunde mașini frigorifice, într-un astfel de sistem care selectează căldura transferată din frigider și încălzire
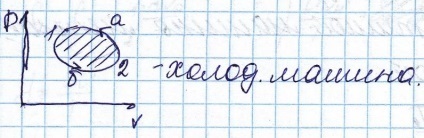
Eficiența termică a mașinii este numit, raportul la valoarea muncii efectuate de căldura produsă de încălzire
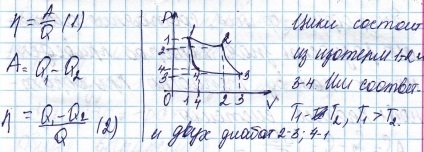
Cantitatea de transfer de căldură de la încălzitor la gaz are loc la o temperatură T1 și din mediul de lucru la un T2 frigider.
Eficiența mașinilor reversibile care funcționează într-un ciclu care este format din două izoterme și două diobat același condensator și încălzire.
Eficiența mașinii este mai puțin ireversibilă, reversibilă

Entrofiya - o funcție diferență a valorilor starea sistemului, care este dat la cantitatea de căldură în procesul invers al sistemului
În cazul în care procesul nu este de comandă reversibil,
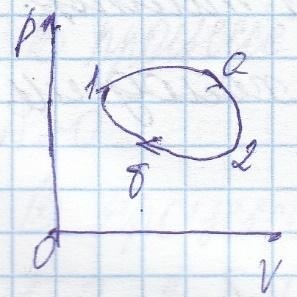
Dacă o parte a ciclului este ireversibil, iar întregul ciclu este ireversibil

Cunoscând expresia acestor potențiale prin parametri independenți putem calcula ceilalți parametri și caracteristici ale proceselor termodinamice.
Folosind formula 1 termodinamicii

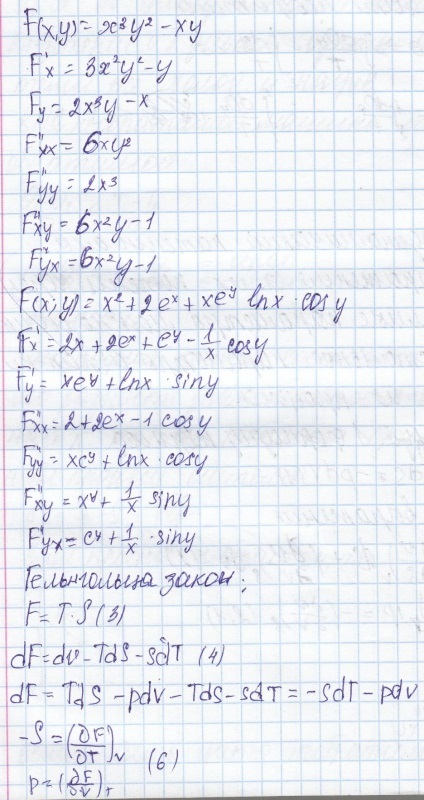
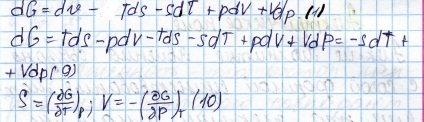
Sistemul cu un număr variabil x
Dacă Gelngaltsa energie diferențială și energia Gibbs să apere:

Potențialul chimic este schimbarea fiind pe o particulă în spațiul corespunzător.