
Acasă | Despre noi | feedback-ul
Principalele incursuri ale compușilor de sulf anorganici în troposferă sunt legate de surse antropice. Acestea reprezintă aproximativ 65% din totalul sulfului anorganic din atmosferă. Aproximativ 95% din această cantitate este dioxidul de sulf.
Din sursele naturale de compuși anorganici ai sulfului, este necesar să se distingă activitatea valurilor în oceane, conducând la formarea de aerosoli. Cantitatea totală de sulf conținută în aerosoli sub formă de sulfuri de magneziu și calciu este estimată la 44 milioane tone pe an, ceea ce reprezintă aproximativ 30% din intrarea în atmosferă ca compuși anorganici.
Așa cum am menționat deja mai sus, în troposferă există procese de oxidare a compușilor de sulf, principalul oxidant în care sunt radicalii liberi. Hidrogenul sulfurat, de exemplu, este oxidat secvențial la SO2 într-un număr de etape. Un mecanism detaliat pentru acest proces nu a fost încă stabilit. Cea mai probabilă este desfășurarea următoarelor reacții:
HS · + 02® SO + · OH
Dioxidul de sulf rezultat, ca și S02. provenind din alte surse, este oxidat în continuare. Mecanismul acestui proces a fost studiat în detaliu.
Oxidarea dioxidului de sulf poate trece în faza gazoasă - prima cale în fază solidă (adsorbție oxidat precede) - a doua cale și în faza lichidă (oxidare precede absorbție) - a treia cale.
Faza de oxidare în fază gazoasă (prima cale) este istoric prima încercare de a explica procesele de oxidare a dioxidului de sulf în atmosferă. Timp de mulți ani, mecanismul principal al procesului a fost asociat cu formarea dioxidului de sulf în stare excitată, care reacționează cu oxigenul molecular pentru a forma SO3:
SO3 care rezultă interacționează cu o moleculă de apă:
Cu toate acestea, studii din ultimele decenii au arătat că mecanismul considerat este posibil, dar nu principalul proces de oxidare a SO2 în fază gazoasă.
Astfel, acest mecanism de oxidare nu joacă un rol important în transformarea compușilor de sulf în troposferă, iar radicalii liberi joacă un rol principal. Procesele care apar în acest proces pot fi reprezentate de următoarele ecuații de reacție:
Trioxidul de sulf - anhidrida sulfurică - interacționează ușor cu particule de umiditate atmosferică și formează soluții de acid sulfuric [cf. Ecuația (1)], care, reacționând cu amoniacul sau ionii metalici prezenți în particulele de umiditate atmosferică, trec parțial în sulfații corespunzători. În principiu, este vorba de sulfați de amoniu, sodiu, calciu. Formarea de sulfați are loc și în procesul de oxidare pe suprafața particulelor solide prezente în aer. În acest caz, etapele de oxidare sunt precedate de adsorbție, adesea însoțită de o reacție chimică (al doilea mod de oxidare a dioxidului de sulf):
Cea de a treia cale de oxidare a dioxidului de sulf în troposferă este asociată cu absorbția preliminară a SO2 prin picături de umiditate atmosferică. În vremea ploioasă și la o umiditate atmosferică ridicată, această cale de oxidare poate deveni calea principală în timpul transformării dioxidului de sulf. Ca oxidant în condiții naturale, apare adesea peroxid de hidrogen. La valori ridicate ale pH-ului, atunci când în soluție există în principal ioni de SO3-2. viteza de oxidare crește în mod semnificativ. Produsul final al oxidării, ca în cazul oxidării în fază gazoasă, este acidul sulfuric, care poate fi apoi transformat în sulfați.
Pe lângă procesele chimice de transformare a dioxidului de sulf pentru a drena și acid sulfuric sulfații (ieșirea din atmosferă) ale acestor compuși se datorează proceselor umede (cu precipitații) și uscată (în contact cu suprafața solului, iaz sau vegetație) de depunere.
Cel prezentat în Fig. diagrama ilustrează în mod clar partea troposferică a ciclului de compuși anorganici ai sulfului.
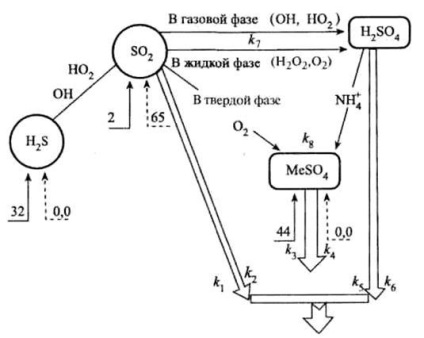
Transformarea compușilor anorganici ai sulfului în troposferă (număr - milioane tone de sulf elementar pe an):
® intrările naturale ale compușilor de sulf;
---® intrările antropice ale compușilor de sulf;
Þ retragerea din atmosferă.
Trebuie menționat faptul că dioxidul de sulf este unul dintre cele mai periculoase gaze printre poluanții cei mai obișnuiți. Este deosebit de periculos pentru sănătatea persoanelor care suferă de boli respiratorii. O corelație liniară a fost stabilită între concentrația de SO2 în aer și incidența bronșitei cronice în populație:
unde y este procentul bolii cu bronșită; x - concentrația de SO2 în aer, mg / m 3.
Din această relație rezultă că atunci când concentrația de SO2 în aer de 0,5 mg / m 3 incidență bronșită în populația va fi de 6% la o concentrație de 1,0 mg / m 3 -, cu 5 mg / m 3 13,2% - 71, 2%, iar la o concentrație de 6,8 mg / m 3 întreaga populație va dezvolta bronșită. Aceste previziuni coincid cu rezultatele studiilor efectuate în Germania și în alte țări europene.
Răul principal pentru mediu nu este cauzat atât de SO2 în sine. cât de mult produsul oxidării sale este SO3. De atunci, formarea acidului sulfuric în umiditate atmosferică [cf. ecuația (1)], iar acest lucru duce la precipitarea așa-numitelor ploi acide. Acest fenomen se răspândește în special în țările din Scandinavia, Europa de Nord, în nordul SUA și în sudul Canadei. Din cauza ploii acide reduce pH-ul corpurilor de apă dulce, ceea ce duce la moartea peștilor și a altor organisme acvatice (vezi. Lecture despre acidificarea corpurilor de apă). Sub influența ploii acide, structurile metalice sunt corodate rapid, integritatea lacurilor este distrusă, clădirile și monumentele de arhitectură sunt distruse. Astfel, acidul sulfuric atmosferic reacționează cu marmura (CaCO3) pentru a forma CaS04. care duce la decojirea pietrei.
Într-un mediu acid crește solubilitatea Al (OH) 3 În TION concentrație> 0,2 mg / l Al 3+ ioni în apă este toxic pentru pești, în afară de aluminiu leagă fosfatul, care reduce rezerva de nutrienți din rezervor. În mediul acvatic crește posibilitatea trecerii la soluții și a ionilor altor metale, ceea ce creează pericolul contaminării toxice a apei și a ecosistemelor solului.
Ploaia acide afectează structura și structura solurilor, ducând la moartea plantelor (în principal conifere). Cu acidificarea solurilor, se produce leșierea ionilor de calciu, magneziu și potasiu, mobilitatea ionilor de metale toxice crește, iar compoziția microorganismelor din sol se schimbă.