După cum sa menționat mai sus, unul dintre cei mai importanți parametri care caracterizează molecula este energia potențială minimă a interacțiunii dintre EPO. Forțele de atracție care acționează între molecule tind să condenseze substanța, adică pentru a aduce moleculele sale mai aproape de o distanță r0 (Fig.3), atunci când energia lor potențială de interacțiune este minimă și egală cu EP0. dar această abordare este împiedicată de mișcarea termică haotică a moleculelor. Intensitatea acestei mișcări este determinată de energia cinetică medie a moleculei, care este de ordinul kT. unde k este constanta Boltzmann. Stările agregate ale unei substanțe depind în mod esențial de raportul dintre valorile EPO și kT.
Să presupunem că temperatura sistemului de molecule luate în considerare este atât de mare încât kT >> EP0. În acest caz, mișcarea termică haotică intensă împiedică forțele atractive să conecteze moleculele la agregatele mai multor particule care s-au convertit la o distanță r0. în coliziuni, energia cinetică mare a moleculelor va rupe cu ușurință aceste agregate în molecule constituente și, astfel, probabilitatea formării de agregate stabile va fi arbitrar mică. În aceste condiții, moleculele luate în considerare vor fi în mod evident într-o stare gazoasă.
Dacă temperatura sistemului de particule este foarte scăzută, adică kT < În cele din urmă, la temperatura sistemului de particule, determinată din egalitatea aproximativă kT ≈ EP0. energia cinetică a mișcării termice a moleculelor, a cărei valoare este aproximativ egală cu energia potențială de atracție, nu poate muta molecula la o distanță mult mai mare decât r0. În aceste condiții, substanța va fi într-o stare agregată în stare lichidă. Astfel, substanța, în funcție de temperatura și de magnitudinea lui EP0. inerente unei anumite clase de molecule constitutive, vor fi într-o stare gazoasă, solidă sau lichidă. În acest caz, temperatura tranziției de la o stare agregată la alta este determinată de numărul EP0 caracteristic unei anumite substanțe (un fel de molecule). Se știe că în gazele inerte (heliu, neon, argon etc.), valoarea EPO este relativ mică. Prin urmare, într-o gamă largă de temperaturi, acestea sunt într-o stare gazoasă și trec în lichid la temperaturi foarte scăzute, aproape de zero. Pentru metale EP0. dimpotrivă, de regulă, mare. Prin urmare, la temperaturi suficient de ridicate, metalele sunt în stare solidă. Rezumând, putem spune că, dacă substanța este la În încheierea acestei secțiuni, să notăm ce fel de mișcări o moleculă de materie care se află într-o anumită experiență de stare agregată. În condiții normale, distanța dintre moleculele din gaz este de zeci de ori mai mare (vezi exemplul de la punctul 1.1) decât dimensiunile lor; cele mai multe ori se mută într-o linie dreaptă, fără interacțiune-acțiune și este doar o parte mult mai mică din timp, atunci când găsesc ulterior distanțelor apropiate de alte molecule, interactioneaza cu ei, schimbarea direcției sale de mișcare. Astfel, în starea de gaz, mișcarea moleculei arată cum este prezentată schematic în figura 6a.
temperatura foarte scăzută, moleculele au o energie cinetică foarte mică și forțele de atracție mențin moleculele împreună într-o structură ordonată sau într-o rețea. În acest caz, moleculele oscilează în apropierea nodurilor (pozițiile de echilibru) ale rețelei cristaline cu amplitudinea, cu atât mai mică este temperatura. Dacă energia este adusă la cristal, temperatura crește și moleculele oscilează din ce în ce mai mult cu privire la pozițiile lor de echilibru. În cazul în care cristalul este adus suficientă energie, structura ordonată a cristalului molecular este distrus-cal energia cinetică a mișcării termice a moleculelor și sunt liberi să „alunece“ de-a lungul celuilalt, deși încă udate-sayutsya unele cu altele. Această situație corespunde stare lichidă, iar temperatura de tranziție între cristalin și lichid-CoC-fiind determinată în ordinea de mărime determinată de ecuația kTpl = EP0. unde Tm este punctul de topire al substanței. Lichidul este încă reținut de forțele de atracție, deși moleculele au o energie cinetică suficient de mare de mișcare pentru a rămâne în poziții fixe de echilibru. În cazul în care lichidul de a lua înainte, în plus, moleculele de energie încep să se miște destul de repede și sunt capabili să depășească forța de gravitație, sunt complet separate una de cealaltă și se deplasează în spațiu pe o cale independentă. Această situație corespunde stării gazoase, iar temperatura de tranziție dintre lichid și gaz este denumită punctul de fierbere.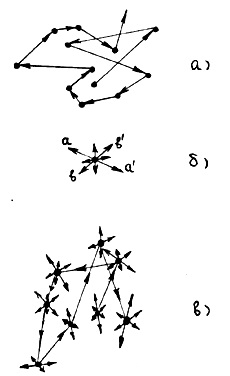
În stare solidă, fiecare moleculă (atom) substanței este în echilibru poziția Xia (punctul zăbrele), în jurul căruia ea suferă mici oscilații și direcția (k-măsură la aa „în figura 6, b) și amplitudinea acestor oscilații aleator (de exemplu, direcția bb ') după un timp mult mai lung decât perioada acestor oscilații; Frecvențele vibrațiilor moleculelor situate în locuri diferite, în general, nu sunt aceleași. Traiectoria mișcării unei molecule individuale solide este în general prezentată în figura 6b.
Moleculele solidului sunt împachetate atât de strâns încât distanța dintre ele este aproximativ egală cu diametrul lor, adică distanța r0 din Fig. Se știe din experiență că densitatea stării lichide este cu aproximativ 10% mai mică decât densitatea solidă, cu alte lucruri egale. Prin urmare, distanța dintre moleculele de stare lichidă este ceva mai mare decât r0. Având în vedere că moleculele de lichid de pe Lada încă mai mare energia cinetică a mișcării termice, este de așteptat ca, în contrast cu starea solidă, ei pot, care efectuează o mișcare oscilatorie, este destul de ușor să își schimbe poziția, se deplasează la o distanță, nu depășește în mod semnificativ diametrul moleculei. Traiectoria mișcării moleculei lichide în principalele caracteristici arată așa cum este prezentat schematic în figura 6, c. Astfel, mișcarea moleculelor într-un lichid combina mișcarea post-translație, așa cum este cazul în gazul și vibrațională care se observă în stare solidă.
În ciuda naturii inegale a mișcării moleculelor în diferite stări agregate, caracterul întâmplător și imprevizibil al acestor mișcări este obișnuit. Energia cinetică medie a acestor mișcări dezordonate determină starea termică a substanței, temperatura ei.