Tabelul 1. Clasificarea detergenților.
Detergenții sunt compuși organici constând dintr-un fragment de hidrocarbură hidrofobă și dintr-un grup cap de încărcare hidrofil (Figura 1A). Atunci când se dizolvă în apă la o anumită concentrație și temperatură a moleculelor de detergent formează micele cu partea hidrofobă a miceliului și în cadrul grupului cap pe exterior (Fig. 1B). Astfel, nucleul hidrofob al micelii se leagă de regiunile hidrofobe ale proteinelor. Cantitatea de molecule de detergent în numărul de agregare micelelor se numește, care este un parametru important utilizat pentru a evalua solubilitatea proteinelor de membrană [2]. Lungimea porțiunii hidrofobe este direct proporțională cu gradul de hidrofobie și destul de constantă pentru diferiți detergenți, în timp ce grupul cap încărcat este variabilă și, pornind de la caracteristicile sale, detergenții sunt împărțite în trei tipuri: ionic (anionice sau cationice), zwitterionice și neionici. Concentrația minimă a detergenților la care micellele sunt detectate la o anumită temperatură se numește concentrație micelară critică (CMC). La o concentrație sub KMC, se observă numai monomeri; la concentrații deasupra CMC, micelii și monomerii coexistă cu alte faze nemiceliare care nu se dizolvă în apă. În plus, temperatura scăzută la care micelurile se formează se numește temperatura micelară critică (KMT). Astfel, temperatura și concentrația sunt parametri importanți ai separării fazelor și a solubilității detergentului. De asemenea, KMC depinde de gradul de lipofilitate al grupului capului. Ca regulă, lipofilicitatea scăzută sau lipofobia conduce la un nivel ridicat de CMC.
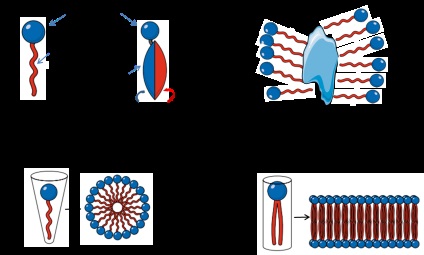
Figura 1. Structura generală a monomerilor detergenți. Adaptat de la Anatrație.
Detergenții ionici constau dintr-un lanț hidrofob și dintr-un grup cap de sarcină, care poate fi fie un anion, fie un cation. De regulă, au un CMC mai mare decât detergenții neionici. Aceste detergenți sunt mai puternice.
Sodiu sulfat de sodiu (SDS) - SDS anionic este un surfactant foarte eficient pentru dizolvarea coloidală a aproape orice proteină. Distruge legăturile ne-covalente ale proteinelor, provocând astfel denaturarea lor, ceea ce duce la pierderea conformității și funcției lor native. SDS se leagă de proteină într-un raport în greutate de 1,4: 1 (sau un anion SDS-doi aminoacizi) și, prin urmare, măști taxa de proteine, care adaugă o sarcină negativă pentru toate proteinele dintr-un eșantion, în ciuda indicelui lor izoelectrice (PI). Acesta este motivul principal pentru utilizarea pe scară largă în electroforeza SDS de denaturare în gel de poliacrilamidă (SDS-PAGE). De obicei, pentru liza completă a celulelor în prezența SDS, proba trebuie omogenizate prin sonicare (ultrasonikatsii supus) și a trecut de mai multe ori printr-un ac (19G), pentru a asigura degradarea ADN-ului. Deoarece SDS provoacă denaturarea proteinelor și a distruge structura lor tridimensională, acesta nu trebuie utilizat în cazurile în care este necesar sau proteinele active, pentru studierea interacțiunilor proteină-proteină. Precauții suplimentare trebuie luate atunci când se utilizează detergenți ionici, deoarece unele dintre proprietățile lor pot varia în soluții tampon cu tărie ionică variabilă (de exemplu, CMC scade la 0,5 mmol de 8 prin creșterea concentrației de NaCI la 0 la 500 mM). Mai mult, SDS este precipitat la temperatură scăzută, din cauza unuia dintre cele mai mari între detergenți KMT, iar acest efect este sporit în prezența sărurilor de potasiu. Acest fenomen poate fi folosit pentru a purifica o probă de proteine din SDS [3].
Datorită grupurilor de capuri polare încărcate, detergenții ionici nu pot fi îndepărtați prin cromatografie cu schimb de ioni.
Detergenții nonionici diferă de detergenții ionici prin faptul că grupul lor de cap nu este încărcat și hidrofil. Acestea sunt considerate substanțe moi de suprafață, deoarece distrug interacțiunile protein-lipide și interlipid, dar nu proteine-proteice, iar cele mai multe dintre ele nu provoacă denaturarea proteinelor. Astfel, proteinele pot fi dizolvate și izolate în forma lor naturală și activă, păstrând în același timp interacțiunile proteice. Acesta este principalul lor avantaj și se acordă preferință în izolarea proteinelor membranare.
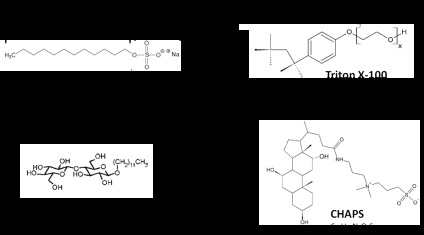
Figura 2. Structura și formulele celor mai utilizate detergenți Adaptați de la G-Biosciences.
Triton X-100 este cel mai tipic exemplu de surfactant neionic, care este preferat pentru majoritatea experimentelor care utilizează imunoprecipitarea. Toți membrii acestui grup (Triton X100, Triton X114, Nonidet P40, Igepal ® CA-630) sunt foarte asemănătoare și diferă doar în numărul mediu (N) monomerilor în micelare (9,6, 8,0, 9,0 și 9,5, respectiv) și în mărimea grupului capului PEG [4] Triton X100 este un derivat de polioxietilenă și conține o grupare alchilfenil hidrofobă. KMC are o valoare scăzută și, prin urmare, Triton X-100 nu este ușor de îndepărtat prin dializă. Temperatura de formare a precipitatului este de 64 ° C și la această temperatură se observă separarea fazelor.
N-dodecil-β-D-maltozida (DDM) reprezintă un surfactant glicozidice larg utilizat pentru extracția proteinelor hidrofobe și membranare, în cazurile care necesită menținerea activității. Este mai eficient decât alte surfactanți, de exemplu, CHAPS sau NP-40 [5]. lanț glicozidic în siturile sale lipofile, ridicat CMC (0,17 mmol) și suprafața interioară a miceliilor creează o micromediu ideală asemănătoare apei pentru dizolvarea stabilității coloidale și conservarea membranelor și proteine hidrofobe.
Digitoninul este obținut dintr-un purpure digitalis (Digitalis purpurea), este utilizat pentru membranele plasmatice eucariote. Sarkozil și Triton X-100 pot solubiliza o membrană internă, dar nu o membrană externă.
Tween-20 și Tween-80 se referă la agenți tensioactivi polisorbat constând dintr-un ester de acid gras și un lanț polioxietilenic lung. Aceștia au un CMC foarte scăzut și, de regulă, sunt agenți tensioactivi ușori, nu afectează activitatea proteică și sunt eficienți pentru solubilizare. Aceste ingrediente sunt de multe ori nu tampon soluții pentru celulele liză și aplicațiile lor normale ca detergenți, sunt imunoblot și ELISA, deoarece acestea contribuie la minimizarea nespecifică legarea anticorpilor și îndepărtarea fragmentelor nelegate.
Majoritatea detergenților neionici pot interfera cu spectrofotometria ultravioletă (UV), în special cu Triton X100, deoarece conțin un inel fenilic și absoarbe lumina UV. Astfel, identificarea proteinei la 280 nm va fi inexactă.
Grupurile principale de detergenți zwitterionici sau amfoterici sunt hidrofili și conțin încărcături pozitive și negative în cantități egale, rezultând o încărcare totală neutră. Acestea sunt, de regulă, mai stricte decât surfactanții neionici. Cel mai tipic exemplu de detergenți zwitterionic sau amfoteric este 3 - [(3-colamidopropil) dimetil amonio] -1-propansulfonat, mai bine cunoscut ca CHAPS. KMC-ul său ridicat (6 mmol la temperatura camerei) poate fi eficient eliminat prin dializă. Acest lucru este adesea folosit în prepararea probelor la o concentrație de 2-4% pentru focalizarea izoelectrică și pentru electroforeza 2D. CHAPSO diferă de CHAPS că conține un grup de capuri mai polari care îl face mai solubil. Astfel, este utilizat în principal pentru dizolvarea coloidală a proteinelor integrale membranare.
Agenții chaotropici ca agenți activi de suprafață în care acestea perturba interacțiuni necovalente (legături de hidrogen, interacțiuni dipol-dipol, interacțiuni hidrofobe), promovând denaturarea proteinei, care în acest caz este de obicei reversibilă. Uree singur sau în combinație cu tiouree sau alți detergenți, este cel mai frecvent utilizate chaotropii folosind electroforeza cu gel 2D și scindarea enzimatică a proteinelor în soluție pentru procesele de curgere proteomica. Atunci când se utilizează uree, ar trebui să se acorde atenție evitării încălzirii probelor la peste 37 ° C, deoarece acest lucru duce la carbamilarea proteinelor [6].
Detergenți pentru izolarea proteinelor membranare
Izolarea proteinelor membranare este de un interes, dar are anumite dificultăți în comparație cu eliberarea de proteine citosolice și nucleoplasmice. Principalele motive sunt dificultatea solubilizarea lor în soluții apoase, structura complexă a stratului lipidic și domeniile lor hidrofili și hidrofobi, precum și un nivel scăzut de exprimare. Pentru a dizolva proteinele membranare, detergenții cu CMC înalt trebuie selectați. Volumul soluției tampon este, de asemenea, important, deoarece este necesară o cantitate suficientă de detergent pentru a dizolva toate proteinele membranare din probă. Potrivit lui Linke [2]. Cel puțin o micelă per proteină membranară este necesară pentru a simula suficient mediul membranei lipidice (Figura 1C-D). În principiu, prin schimbarea temperaturii și concentrației de sare într-o soluție tampon, dizolvarea eficientă a proteinelor membranare poate fi realizată prin utilizarea separării fazelor. În acest caz, proteinele membranare înconjurate de miceli precipită cu detergent și proteinele solubile rămân în supernatant. Temperatura la care este împărțită detergentul în două faze se numește punctul de nori. În plus față de temperatura, punctul de nor depinde de aditivi într-o soluție tampon, cum ar fi glicerol sau săruri (de exemplu, Triton X114 are un punct de nor de 23 ° C, dar în prezența a 20% glicerol, punctul de opacitate se reduce la 4 ° C). Acest lucru este foarte important când stabilitatea proteinei este expusă la temperaturi ridicate.
Un detergent bun trebuie să lizeze celulele, să solubilizeze proteinele și să fie adecvat pentru metodele ulterioare. Alegerea proteinei solubile în formă naturală sau denaturată este a doua întrebare care trebuie răspunsă. Nu există detergent ideal pentru toate aplicațiile, și chiar în aceeași aplicație, rezultatul va varia în funcție de proteina de interes (Tabelul 2). Astfel, încercarea și eroarea sunt cele mai bune strategii și trebuie testate diverse detergenți. În plus, cea mai bună practică de a evita hidroliza și oxidarea este prepararea unei soluții proaspete de lucru cu detergenți.