Legarea metalului este un tip de legare a atomilor în substanțele cristaline care posedă proprietăți metalice (metale, metale). M. cu. se datorează concentrației mari de electroni cvasi-liberi (electroni de conducere) în astfel de cristale. Un gaz de electroni încărcat negativ "conectează" ionii încărcați pozitiv unul cu celălalt.
Legarea covalentă este una dintre tipurile de legături chimice dintre doi atomi, care este realizată de o pereche electronică comună (un electron din fiecare atom). C. cu. există atât în molecule (în orice stare agregată), cât și între atomi care formează rețeaua unui cristal. C. cu. pot lega atomi identici (în molecule H2, Cl2 în cristale de diamant) sau diferite (în molecule de apă, în cristale de carborund SiC). Aproape toate tipurile de legături de bază în moleculele de compuși organici sunt covalenți (C-C, C-H, C-N, etc.). C. cu. sunt foarte durabile. Aceasta explică activitatea chimică scăzută a hidrocarburilor parafinice. Mulți compuși anorganici ale căror cristale au o latură atomică, adică se formează cu ajutorul nanotuburilor de carbon. Sunt de înaltă topire, au duritate ridicată și rezistență la uzură. Acestea includ unele carburi, siliciuri, boruri, nitruri (în special celebrul borazon BN), care au găsit aplicații în noua tehnică.
Ionic bond - obligațiuni electrovalent, legătura bifuncțional, un tip de legături chimice, care se bazează pe interacțiunea electrostatică dintre ionii încărcați opus. Astfel de legături într-o formă relativ pură în halogenuri alcaline, de exemplu KF, deoarece atomii de metale alcaline sunt unul electroni confine slabi (energie de aproximativ 3,5 eV legare), și atomii de halogen au cea mai mare afinitate pentru electroni. Dar chiar și în cristale (și chiar mai mult în molecule) acestor compuși, transferul total al unui electron de la un atom de metal la un atom de halogen nu, în majoritatea cazurilor, să apară. Ideile mai larg răspândite despre formarea în alte cazuri a ionilor de Ca, 2, trei sau patru încărcați. C 2-. B 3+. Si 4+ nu au fost confirmate, deoarece în astfel de cazuri se formează o legătură chimică într-un mod mai complicat. Pentru a evalua gradul de ionicitate al unei legături, se utilizează conceptul de încărcare ionică eficientă.
Structura inițială a oțelului de scule U11 cu un conținut ridicat de carbon înainte de încălzirea pentru răcire este perlit + carburi.
Puncte critice pentru oțel V11: A c 1 = 730 ° C. Și cm = 810 ° С.
Condițiile de încălzire optime pentru durificarea oțelului hypereutectoid (C%> 0,8%) face ca AS 1 + (30 ÷ 50º), adică pentru U11 - 760-780 ° C. În acest caz, după stingere, avem o granulație fină, care asigură cele mai bune proprietăți mecanice ale oțelului U11.
Încălzirea și îmbătrânirea oțelului U11 la 850 ° C înainte de stingere duce la creșterea boabelor și deteriorarea proprietăților mecanice ale oțelului după tratamentul termic. Structura cu granulație grosieră determină o fragilitate sporită a oțelului. uneori duce la fisuri.
Încălzirea oțelului preeutectoid constă în încălzirea oțelului la o temperatură mai mare decât temperatura critică (Ac3), în procesul de înmuiere și răcirea ulterioară la o viteză care depășește cea critică.
Temperatura punctului Ac3 pentru oțelul 30 este de 820 ° C.
Tratamentul termic necesar pentru a obține o duritate de 350 HB este o stingere izotermică pentru troostite. Ca mediu de răcire pentru călirea izotermică, sărurile topite sunt cele mai des folosite, intervalul de temperatură fiind determinat experimental.
Atunci când oțelul V8 este încălzit deasupra A 1, perlitul trece în austenită. Ca urmare a răcirii topiturii sărurilor din austenită, se formează o structură feritice-cementită - troostite.
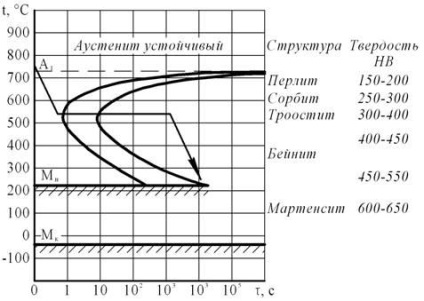
Figura 6 - Diagrama transformării izotermice a Au austenite din oțel U8
Ca rezultat al tratamentului termic, duritatea oțelului este de 350 N, structura fiind mai mare.
Cristalizarea primară a aliajelor sistemului de fier-carbon începe după atingerea temperaturilor corespunzătoare liniei ABCD (linia liquidus) și se termină la temperaturi care formează linia AHJECF (linia solidus).
La temperaturile corespunzătoare liniei BC, austenita cristalizează din soluția lichidă. În aliaje care conțin de la 4,3% până la 6,67% carbon, la temperaturi corespunzătoare liniei CD. Se creează cristalite de cementită primară. Cementite, cristalizat din faza lichidă, este denumit primar. Din punctul B, la o temperatură de 1147 ° C și concentrația de carbon în suspensie 4,3% din eutectic este format, care se numește ledeburită. Eutectică pentru a forma o formulă ledeburită poate fi scris ZHR4,3 A [A2,14 TS6,67 +]. Procesul de cristalizare primară a fontelor turnate se termină în linia ECF cu formarea de ledeburite.
Astfel, structura de fier turnat sub 1147 ° C va fi: hypoeutectic - Ledebur + austenita, eutectic - Ledebur și hipereutectice - cementita (primar) + Ledebur.
Transformările care se produc în stare solidă se numesc cristalizare secundară. Acestea sunt asociate cu o tranziție la răcirea fierului γ în a-fier și descompunerea austenitei.
Linia GS corespunde temperaturilor debutului transformării austenitei în ferită. Sub linia GS, aliajele constau din ferită și austenită.
Linia E S arată temperatura debutului de izolare a cementitei de la austenită datorită unei scăderi a solubilității carbonului în austenită cu scăderea temperaturii. Cementite, eliberat din austenită, se numește cementită secundară.
La punctul S, la o temperatură de 727 ° C și concentrația de carbon în amestec eutectoid austenită 0,8% a fost format constând din ferită și cementita, care se numește perlit. Perlit se obține prin precipitarea simultană a particulelor de ferită și cementită austenită. Procesul de transformare a austenitei în perlită poate fi scris A0,8 formula II [F0,03 TS6,67 +].
Linia PQ indică o scădere a solubilității carbonului în ferită la răcire și eliberarea cementitei, numită cementită terțiară.
Prin urmare, aliaje care conțin mai puțin de 0,008% carbon (punctul Q) sunt o singură fază de ferită și au o structură netă și aliaje care conțin carbon din 0,008 la 0,03% - structura din ferită + fier tehnic terțiar și numit cementită.
Oțelurile preeutectoide la o temperatură sub 727 ° C au o structură de ferită + perlit și oțeluri hipereutectoide - perlite + cementite secundare sub forma unei grile de-a lungul granițelor granulelor.
În fonta preeutectică, în intervalul de temperatură de 1147-727 ° C, cementitul secundar este eliberat din austenită după răcire din austenită, datorită unei scăderi a solubilității carbonului (linia ES). Când temperatura ajunge la 727 ° C (linia PSK), austenita epuizată cu carbon la 0,8% (punctul S), transformându-se în perlit. Astfel, după răcirea finală, structura fontei pre-eutectice constă din perlit, cementită secundară și ledeburite convertite (perlit + cementite).
Structura fontei eutectice la temperaturi sub 727 ° C constă în transformarea ledeburiților. Fierul hipereutectic la temperaturi sub 727 ° C constă din ledeburite transformate și cementite primare.
Regula de fază stabilește relația dintre numărul de grade de libertate, numărul componentelor și numărul de faze și se exprimă prin ecuația:
C = K + 1 - F,
unde C este numărul de grade de libertate ale sistemului;
K este numărul de componente care alcătuiesc sistemul;
1 - numărul factorilor externi (factorul extern ia în considerare doar temperatura, deoarece presiunea cu excepția efect redus foarte mare asupra echilibrelor fază a aliajelor din statele solide și lichide);
Ф este numărul de faze în echilibru.
Aliajul de fier cu carbon, care conține 0,01% C, se numește oțel preeutectoid. Structura sa la temperatura camerei este Ferrit + Cementite (primar).
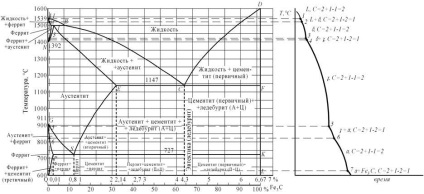
Figura 5. Diagrama a-a cementitei de fier,
b-curba de răcire pentru un aliaj care conține 0,01% carbon