3. Molecule de apă
În viața umană, ca și în viața oricărei alte creaturi, apa joacă un rol imens. Este nevoie de apă pentru băut și gătit, pentru spălare este nevoie de apă. De multă vreme omul și-a dat seama că apa este necesară pentru câmpurile sale. Prin urmare, nu este surprinzător faptul că și popoarele antice, care au trăit cu mii de ani înaintea noastră, au privit apa ca o substanță specială, principiul fundamental al tot ceea ce există.
"Apa ca fluid, în mișcare, tot pătrunzând, a fost începutul tuturor lucrurilor" - a învățat acum două și o jumătate de mie de ani "pe înțeleptul grec Thales de Milet. Aproximativ două sute de ani mai târziu, Aristotel, cel mai mare filosof al lumii antice, număra deja câteva astfel de principii primare, "elementele de bază" ale lumii, dar printre ele era apă.
În afirmațiile grecilor antice, indiferent de aceste afirmații care ni se par a fi acum naivi, au reflectat deja o înțelegere profundă a sensului apei în toate fenomenele naturii și ale vieții umane.
Aproape 20 de secole au trecut. Însăși conceptul de "element" sa schimbat semnificativ. Elementul chimic a fost considerat o substanță simplă, care nu mai poate fi descompusă în continuare în substanțe mai simple. Numărul elementelor a crescut și a crescut. Lista acestor elemente a fost din nou apă.
Și au existat motive pentru asta. La urma urmei, oamenii de știință din acea vreme, observând diverse fenomene în care participă apa, nu au observat niciodată că s-au schimbat chimic. În fața lor, se întărea în gheață, dar gheața se topea în aceeași apă. Apa a fost încălzită la fierbere și evaporată, dar, răcirea, vaporii s-au adunat din nou în picături de apă. Apa ca substanță a rămas "în sine" în toate procesele și a fost considerată a fi o substanță indisolubilă și simplă.
Numai la sfârșitul secolului al XVIII-lea sa descoperit că apa este o substanță complexă: apa a fost obținută prin mijloace artificiale, prin arderea unui gaz de hidrogen în oxigen. Acest lucru a demonstrat că apa constă în hidrogen și oxigen.
Aproximativ în același timp, compoziția complexă a apei sa dovedit, de asemenea, prin metoda inversă - descompunerea apei în părțile componente ale acesteia. Acest lucru a fost făcut de către omul de știință francez Lavoisier. Prin tunul roșu-fierbinte, a lăsat în câteva apă. Din acțiunea temperaturii ridicate, apa se descompune. Oxigenul a fost combinat cu fier, iar pe suprafața interioară a cilindrului a apărut o scară (un compus de fier-oxigen) și gazul de hidrogen a ieșit din trunchi.
Câțiva ani mai târziu, apa a fost mai întâi descompusă în părțile sale componente prin curent electric. În acest fel, sa stabilit în mod clar că greutatea apei este 11.11 la suta hidrogen si 88,89 la suta de oxigen, cu hidrogen eliberat volumul de apă de două ori decât oxigenul.
Dacă atât amestecul de gaz separat, apoi la temperatura camerei, acest amestec poate rămâne neschimbată pentru o lungă perioadă de timp. Pentru ca numai o șesime din acest amestec să se transforme în apă, ar trebui să așteptăm 54 de miliarde de ani. Dar este necesar pentru a aduce amestecul la un chibrit sau trece prin ea o scânteie electrică între oxigen și hidrogen apar instantaneu reacția chimică a hidrogenului ars în oxigen, iar rezultatul va fi apa. Această experiență ar trebui să fie efectuată cu mare grijă, deoarece arderea este întotdeauna însoțită de o explozie de mare putere. Prin urmare, un amestec format din două volume de hidrogen și un volum de oxigen și se numește amestec exploziv.
Pentru a provoca o reacție între oxigen și hidrogen, nu este necesar să se încălzească întregul amestec. Suficient pentru a încălzi cel mai mic volum. În acest volum începe procesul de ardere a hidrogenului - legătura cu oxigenul. În același timp, se eliberează multă căldură (zece grame de amestec exploziv dau o cantitate de căldură în timpul arderii, care este suficientă pentru a fierbe aproape jumătate de litru de apă). Căldura eliberată este transferată în părțile vecine ale amestecului, iar procesul de ardere se răspândește cu o rapiditate extremă pe întregul volum.
Temperatura în flacăra de gaz incendiu depășește 3000 de grade. Prin urmare, gazul exploziv este utilizat și pentru sudarea autogenă.
Deci, apa este o substanță complexă constând din oxigen și hidrogen. Cum se construiește molecula de apă? Care sunt atomii de oxigen și de hidrogen din ea?
Știința modernă are o metode foarte precise de investigare care permit să pătrundă în structura materiei atât de mult încât chiar și acum se poate spune cu încredere deplină, nu numai că dintre care atomii sunt molecule de unul sau o altă substanță compusă, dar, de asemenea, cu privire la modul aranjate atomii în molecule . Fiecare moleculă de apă constă din trei atomi: un atom de oxigen și doi atomi de hidrogen. Toți trei atomi în moleculă sunt aranjate astfel încât, dacă conectați mental liniile lor, atunci se formează un triunghi isoscel, adică triunghi în care cele două părți sunt egale (Fig. 3). În partea de sus există un atom de oxigen și în două colțuri la bază - pe atomul de hidrogen. Distanțele dintre atomii de oxigen și hidrogen sunt aceiași și egală cu zece miliarde de acțiuni de 97 de centimetri. Distanța dintre atomii de hidrogen este de zece miliarde parts 154 centimetri, în timp ce unghiul la vârful în care atomul de oxigen este de aproximativ 105 de grade. Dacă mărimea moleculei este mărită de zece miliarde de ori, acest triunghi se va potrivi pe o masă de dimensiuni medii.
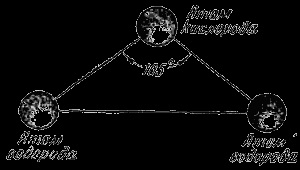
Fig. 3. Aranjarea atomilor într-o moleculă de apă.
Cititorul poate întreba: De ce sunt atomii din molecula de apă aranjați sub forma unui triunghi și nu în linie dreaptă - în mijlocul unui atom de oxigen și la marginile atomilor de hidrogen?
Puteți explica acest lucru în acest fel. Fiecare organism din natură tinde să adopte poziția cea mai stabilă. Mingea aruncată pe un acoperiș neted nu va rămâne pe suprafața ei înclinată și sub acțiunea gravitației va aluneca în mod necesar în jos. Dacă legăm o greutate la filet și țineți firul pentru capătul liber, greutățile vor strânge firul și se vor așeza exact de-a lungul liniei de plumb. Vom lua greutățile ușor în lateral și le vom elibera - greutățile nu vor rămâne în noua stare instabilă și, sub acțiunea gravitației, se vor întoarce rapid la poziția inițială. Deci, într-o moleculă de apă. Atomii sunt conectați între ei prin forțe, care se numesc forțe de afinitate chimică. Mărimea și direcția acțiunii acestor forțe sunt astfel încât molecula de apă este stabilă tocmai atunci când atomii formează un triunghi. Orice altă "construcție" de atomi este mai puțin stabilă. Și dacă, dintr-un anumit motiv, aranjamentul "atomilor" se schimbă, atunci pentru a elimina această cauză, atomii din nou formează același triunghi.
Trebuie spus că forțele care dețin atomii de hidrogen și oxigen în molecula de apă sunt foarte mari. Este nevoie de o energie foarte mare, astfel încât legătura dintre atomi "se descompune". Putem încălzi apă până la 1400 de grade și dintr-un milion de molecule de apă la această temperatură, doar aproximativ o sută de molecule vor fi descompuse în hidrogen și oxigen. Chiar și la 3092 de grade, doar 13% din toate moleculele de apă sunt distruse.
Toată apa, ori de câte ori a fost luată - de la Oceanul Arctic, de la minele adânci din Donbass, a fost reținut într-un fulg de zăpadă sau strălucește în lumina Dewdrops dimineața devreme pe o floare - orice apă compusă din molecule construite identic. Cu toate acestea, aranjamentul reciproc al moleculelor individuale unul față de celălalt în apă lichidă, fulg de nea, sau o pereche de cazan de abur este neuniformă.
vapori de apă, grade încălzite până la trei sute, la presiune atmosferică, similar cu un gaz convențional: în care distanțele dintre molecule sunt suficient de mari, astfel încât fiecare molecula individ poate exista în mai mult sau mai puțin independent, fără a se confrunta cu o interacțiune semnificativă cu vecinii săi, cu excepția, desigur, cele Cazurile în care moleculele ca urmare a mișcării termice aleatorii se ciocnesc una cu cealaltă.
Într-o fulg de zăpadă sau o bucată de gheață, moleculele sunt aduse împreună și fixate în anumite locuri ale rețelei de cristal; Propunerile de molecule în majoritate sunt limitate la oscilații în jurul unor puncte medii.
Și cum sunt moleculele în apă lichidă?
În domeniul științei nu există încă o teorie strictă și stabilă cu privire la structura lichidelor, în special a apei. Se presupune că apa lichidă din structura sa este ceva între cristalele de gheață și vapori. Studiul structurii apei prin razele X infraroșii și a făcut posibilă să se presupună că, la temperaturi apropiate de punctul de congelare, moleculele lichide de apă sunt colectate în grupuri mici și „ambalate“ într-un spațiu de aproximativ sub formă de cristale, iar la temperaturi apropiate de punctul de fierbere apă, la presiune normală, sunt localizate mai liber, aleatoriu. Cu toate acestea, "cadrul", compus în apă lichidă din molecule individuale, trebuie să fie foarte flexibil. În caz contrar, ar fi dificil să se explice mobilitatea apei, capacitatea sa de a fi un „fluid de lucru“, de conducere roata turbinei grele, și un purtător de diverse substanțe nutritive pe cele mai bune vase ale organismelor vii.
Aparent, chiar și în vaporii de apă la temperaturi scăzute, unele dintre moleculele de apă sunt combinate sau, cum se spune, asociate.
Apa este cea mai comună lichidă în natură. Suntem atât de obișnuiți cu apa, cu diferitele sale manifestări, încât ne pare a fi cel mai obișnuit lichid. Multe proprietăți ale apei sunt baza sistemului nostru de măsurare. Temperatura de topire a gheții noi credem a fi zero grade, iar punctul de fierbere de o sută de grade (acum acceptat aproape peste tot Celsius). Masa apei în volumul unui centimetru cubi pe care o luăm ca măsură a masei - un gram. Cantitatea de căldură care absoarbe un gram de apă când este încălzită cu un grad, numim unitatea de căldură - calorii. Multe instrumente de măsurare sunt calibrate fizica și chimia apei și valorile măsurate pentru alte substanțe sunt, de obicei, în comparație cu numărul obținut pentru apă. Dar, dacă ne uităm cu atenție la comportamentul apei în diferite condiții și se compară cu comportamentul majorității altor lichide, constatăm că nostru lichid „obișnuită“ se comportă foarte ciudat, dacă aceste cuvinte pot exprima caracterul specific al apei, brusc îl diferențiază de toate celelalte lichide .
Acum vom vorbi despre unele dintre cele mai importante și interesante proprietăți ale apei și abaterile de la "regulile" generale ale comportamentului lichidelor.