4 Pigmenți de cloroplasți
Pigmentele sunt cel mai important component al aparatului fotosintetic. Studiul pigmentilor din plante sa accelerat brusc datorita muncii fiziologului rus MS Tsveta. Încercarea de a găsi o modalitate de a separa pigmenții în substanțe individuale, Culoare în 1901 - 1903. El a descoperit o metodă fundamentală nouă, numită cromatografie de adsorbție. Un solvent cu substanțe dizolvate este trecut prin coloană cu un sorbent. Deoarece substanțele diferă în funcție de gradul de adsorbție, ele se mișcă prin coloană la rate diferite. Ca urmare, există o separare a substanțelor. Această tehnică este utilizată pe scară largă în biochimia modernă, în chimie și în unele industrii. Folosind metoda cromatografică, Color a detectat două clorofile a și b și a separat pigmenții galbeni ai foii în trei fracții.
Plastidele pigmentare aparțin a trei clase de substanțe: clorofilă, fibrociline și carotenoide.
4.1 Clorofile: compoziție, structură, biosinteză, proprietăți optice și chimice, valoare
Pentru prima dată clorofila sub formă cristalină a fost descrisă de către fiziolog rus și botanist IP Borodin în 1883. Mai târziu sa dovedit că acest lucru nu este clorofilă, și o formă modificată - ethylchlorophyllide.
Politicienii polonezi M. Nentsky și L. Marchlevsky (1897) au descoperit că baza moleculei de clorofilă, ca hemoglobina hemoglobinei, este inelul porfirinic. Astfel, a fost demonstrată similitudinea structurală de bază a acestor pigmenți în plante și animale.
Chimistul german R. Willstatter în 1906-1914. El a stabilit compoziția elementară a clorofilei a - C55H72O5N4Mg și clorofila b - C55H70O6N4Mg, un biochimist german G. Fischer în 1930-1940. a descifrat complet formula structurală a clorofilei. În 1960, chimistul organic R.B. Woodward (SUA) și M. Strehl (Germania) au făcut sinteza artificială de clorofil. Clorofila - dicarboxilic clorofilina ester al acidului, în care o grupare carboxil este esterificată rest de alcool metilic, și alte monohidric alcool nesaturat reziduuri fitol. Formula structurală a clorofilei a este prezentată în figură:
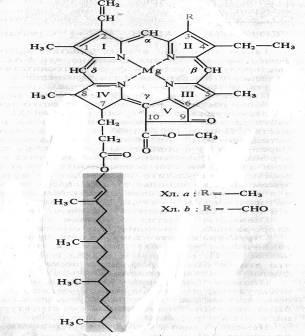
Cele patru inele de pirol (I-IV) sunt unite prin punți de metan, formând un miez de porfirină. atomii de carbon din inelul exterior tetrapirolic sunt numerotate de la 1 - 10. atomi de azot ai inelelor pirolului patru coordinare reacționează cu un atom de magneziu. In structura nucleului porfirinic este, de asemenea, un inel ciclopentanic (V), acid ketopropionovoy reziduu format care conține o grupare carbonil reactivă la C9 și grupare carboxil metilat la C10. Structura, formată din inele de tetrapirol și ciclopentan, a fost numită forbin. Lanțul lateral al inelului pirol conține acid propionic, care este legat printr-o legătură esterică cu fitol alcool nesaturat de poliizopren (C20H39OH). La 1, 3, 5 și 8 atomi de carbon ai inelelor de pirol sunt grupări metil, de la a 2 - vinil, de la a 4 - grupa etil. Porfirinic inel este un sistem de nouă perechi de conjugat (conjugat) alternante legături duble și single 18 delocalizate p-electroni. Clorofila b diferă de clorofil prin aceea că în 3-carbon în loc de metil este o grupare formil (-CHO). Structura clorofilei, lipsită de fitol, se numește clorofilidă. Când atomul de magneziu este înlocuit cu protoni în molecula de clorofil, se formează fheopetinele corespunzătoare.
Clorofilele a, b, c, d au fost găsite în plantele și algele superioare. Toate plantele fotosintetice, inclusiv toate grupele de alge, precum și cianobacteriile, conțin clorofile de grupa a. Clorofila b este prezentă în plantele superioare, în algele verzi și în euglena. În algele maro și diatom, clorofila c este prezentă în locul clorofilei b și clorofila d în multe alge roșii. În bacteriile fotosintetice care efectuează fotoreducție, se găsesc diferite bacteriochlorofile.
Biosinteza clorofilelor. Prima etapă a biosintezei clorofilelor în plante este formarea acidului 5-aminolevulinic (A LK) din acizii dicarboxilici C5. Se arată că acidul glutamic prin 2-hidroxiglutaratul este transformat în 4,5-dioxovovalian, care este apoi aminat de alanină sau alți aminoacizi (Figura 5.2). Reacția de transaminare este catalizată de transaminaza ALA care implică fosfat de piridoxal ca coenzima. Pentru sinteza ALA, poate fi de asemenea utilizat acid (2-oxoglutaric) osmoglutaric. Ciclizarea a două molecule de ALA conduce la formarea unui compus de pirol - porfobiinogen. Dintre cele patru inele de pirol, se formează uroporfiriogen, care este transformat în protoporfirin IX. Modul suplimentar al transformărilor protoporfirinei poate fi diferit. Cu participarea hemei formate cu fier, care face parte din citocrom, catalază, peroxidază și hemoglobină. Dacă molecula protoporfirina este activat de magneziu, iar apoi gruparea carboxil este esterificată la C10 metil-6-b-adenozil metionină și se închide inelul ciclopentan (K) este format protochlorophyllide. Sub influența luminii, pentru câteva secunde pentru a chlorophyllide transformat protochlorophyllide ca urmare hidrogenarea dublei legături de la C7 - C8 IV în nucleul pirolic. În plantele inferioare și în unele gimnosperme (în conifere), se poate forma clorofilida pe întuneric. Clorofilida are aceleași proprietăți spectrale ca și clorofila. Ultimul pas în formarea moleculei de clorofilă și - esterificarea fitol, care, la fel ca toate compus poliizopren este sintetizat din acetil-Koa prin intermediul acidului mevalonic. Potrivit lui AA Shlyk (1965), clorofila b poate fi formată din molecule de clorofilă nou sintetizată. Toate procesele descrise, începând cu formarea ALA, se desfășoară în cloroplaste. Primele semne de ecologizare, cultivate în angiospermele etiolate întunecate, observate după 2 - 4 ore după începerea iluminatului.
Proprietățile fizico-chimice ale clorofilelor.
În formă solidă, clorofila a este o substanță amorfă de culoare alb-negru. Punctul de topire al clorofilei a este de 117-120 ° C. Clorofilele sunt foarte solubile în eter etilic, benzen, cloroform, acetonă, alcool etilic, slab solubil în eter de petrol și insolubil în apă. Soluția de clorofilă a în eter etilic are o culoare albastru-verde, clorofila b este galben-verde. Maximele maxime de absorbție exprimate în clorofilele se găsesc în părțile roșii și albastre ale spectrului.
Maximele de absorbție eter etilic clorofilă grup în porțiunea roșie a spectrului - în intervalul 660-663 nm în albastru - 428 - 430 nm, clorofila b -, respectiv, în cadrul 642-644 și 452-455 nm. Clorofilele absorb foarte slab lumina portocalie și galbenă și nu absorb deloc razele verde și infraroșu. Absorbția în partea albastru-violetă a spectrului se datorează unui sistem de legături singulare și duble conjugate ale inelului porfirin al moleculei de clorofil. bandă de absorbție intensă în regiunea roșie asociată cu hidrogenarea dublei legături de la C7 - C8 IV în nucleul pirol (atunci când merge la un chlorophyllide protochlorophyllide) și magneziu în prezența inelului porfirinic. Aceleași condiții contribuie la scăderea absorbției în părțile galben și verde ale spectrului. Substituirea protoni magneziu prin tratament cu rezultate acide în formarea clorofilei feofetina având un maxim de absorbție brun-verde și roșu atenuat. Eliminarea reziduurilor de fitol și alcool metilic prin hidroliză alcalină are un efect redus asupra spectrului de absorbție al clorofilei. Clorofilina are aceleași proprietăți spectrale ca și clorofila: este verde, are maximă absorbție roșie și albastră.
Poziția maximele spectrului de absorbție este influențată de natura moleculelor de clorofilă solvent și reacționează unele cu altele și cu alți pigmenți, lipide și proteine. La molecule agregate de clorofilă (de exemplu, filme solide și clorofilă prezente în cloroplaste) de absorbție maximă roșie este deplasată la lungimi de undă mai lungi (680 nm).
Soluțiile de clorofile în solvenții polari au fluorescență strălucitoare (luminiscență). Eterul etilic al clorofilei și există o fluorescență roșie-rubinie, cu un maxim la 668 nm, clorofila b - .. 648 nm, adică, maximele de fluorescență în conformitate cu regula de mai multe Stokes mutat la lungimi de undă mai spectrului în raport cu maximul de absorbție. Clorofila și clorofila agregată într-o stare nativă (într-o frunză vie) fluoresc ușor. Soluțiile de clorofile sunt de asemenea capabili să fosforescență (m. E. Afterglow lung), al cărei maxim se află în regiunea infraroșu.
Mecanismele de fluorescență și fosforescență, inclusiv moleculele de clorofil, au fost destul de bine studiate. Aceste stări mai stabile de atomi și molecule în care electronii de valență ocupă cele mai mici nivele de energie și distribuite pe acesta în conformitate cu principiul de excluziune (maximum doi electroni cu spin opus pe fiecare orbital). Această stare a moleculei se numește starea de energie de bază singlet (S0). Spinul total (vectorul momentelor magnetice) a tuturor electronilor moleculei în acest caz este zero. Atunci când o moleculă absoarbe un cuantum de lumină, atunci în detrimentul acestei energii, electronul trece în orbite mai libere. Dacă electronul excitat păstrează aceeași direcție de rotație, atunci molecula se află în starea excitată de singlet (S *). Dacă spinul unui electron se întoarce atunci când merge la o orbitală mai mare, atunci această excitație se numește triplet (T *). O tranziție directă de la starea de bază la o stare triplă este un eveniment puțin probabil, deoarece necesită inversarea orientării centrifugării. O bandă în spectrul de absorbție corespunde tranziției moleculei de la starea de bază la starea excitată, care apare atunci când fotonul luminii este absorbit.
Absorbția unui cuantum de lumină roșie de către o moleculă de clorofil are ca rezultat o stare excitată de singlet cu electroni - S * 1.
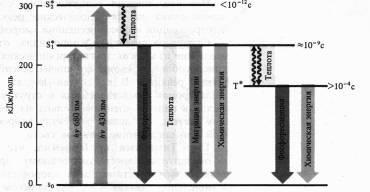
Atunci când se absoarbe un cuantum de lumină albastră cu un nivel de energie mai ridicat, electronul trece pe o orbită mai mare (S * 2). Molecula excitată de clorofil revine la starea solului în diferite moduri. Având o parte din energie sub formă de căldură (în special nivelul S * 1), molecula poate emite un foton de lungime de undă mai (regula Stokes), care se manifestă sub formă de fluorescență. După cum sa menționat deja, clorofila a absoarbe lumina în regiunile roșii și albastre ale spectrului, dar fluoresce doar în roșu. Durata de viață a stării excitate de singlet este de 10-13 - 10-9 s.
Un alt mod de a pierde energie este transferul moleculei de la statul excitat de singlet la tripletul metastabil (cu inversarea spinului). Această tranziție este nonradiativă, adică energia este pierdută sub formă de căldură. Statul excitat triplet are o durată de viață mult mai mare (> 10-4 s). Din starea tripletă, molecula se poate întoarce la starea de bază, emită o lungime de undă chiar mai lungă (decât în cazul fluorescenței) un cuantum de lumină. Aceasta este de obicei o strălucire mai slabă și este fosforescență.
În cele din urmă, energia stării excitate poate fi utilizată pentru reacțiile fotochimice. În acest caz, nu se observă fluorescența și fosforescența clorofilei.
Structura moleculei de clorofilă, selectate în evoluția multor alți pigmenți organici, perfect adaptate funcțiilor sale sensibilizator reacții fotochimice. Acesta este compus din 18 de delocalizate tt-electroni (reprezentat în formula structurală clorofilei sub formă de inele cu 18 atomi de legături duble conjugate) face clorofila molecula ușor excitabil prin absorbția luminii cuante.
Totuși, Timiryazev a sugerat că clorofila este capabilă de transformare redox. Prima reacție clorofila photoreduction a fost realizată în experimente de model A. 1948 g. Krasnovskii în clorofilă, dizolvat în piridină, în condiții anaerobe, sub acțiunea luminii este redus cu acid ascorbic sau alți donori de electroni. Aceasta formează o formă redusă ("roșie") de clorofilă cu o absorbție maximă la 525 nm:
După oprirea luminii, reacția are loc în direcția opusă. Foto-redus clorofila, la rândul său, poate restaura diverși acceptori de electroni. În același sistem model, dar cu adăugarea unui acceptor de electroni, clorofila acționează ca un sensibilizator sub iluminare:
În aceste condiții, NAD +, riboflavina, chinona și Fe3 + sunt reduse. oxigen. Aceste reacții au fost numite "reacțiile lui Krasnovski". Astfel, molecula de clorofil poate acționa nu numai în rolul acceptorului de electron primar, ci și în rolul donatorului său primar.
Rezultă din cele de mai sus rezultă că molecula de clorofilă, datorită caracteristicilor structurale și fizico-chimice pot îndeplini trei funcții importante: 1) absorb selectiv energie luminoasă, 2) pentru a stoca în formă de energie de excitare electronică, 3) converti fotochimic energia starea excitată în energie primară chimică photoreduced și compuși foto-oxidați.
Pentru funcționarea moleculei de clorofil în procesele de fotosinteză, organizarea sa spațială este de o mare importanță. Inelul de magneziu-porfirină al moleculei este o placă aproape plat, cu o grosime de 0,42 nm și o suprafață de 1 nm2. Aceasta este partea hidrofilă a moleculei de clorofil. Un reziduu de fitol alifatic lung (2 nm) care formează un unghi cu inelul porfirinic este polul său hidrofob. necesare interacțiunii moleculei de clorofil cu regiunile hidrofobe ale proteinelor și lipidelor membranare.
Informații despre lucrarea "Fotosinteza ca bază pentru energia biosferei"