Primele experimente, care au arătat posibilitatea acumulării, adică acumulând energie electrică, au fost produse la scurt timp după descoperirea energiei electrice galvanice de către omul de știință italian Volta.
În 1801, un fizician francez Hauterivian prin trecerea apei prin electrozi din platină de curent a constatat că, după ce curentul este întrerupt prin apă, este posibil, electrozi interconectate primesc curent electric intermitent.
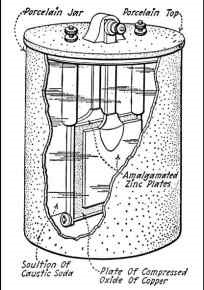
Scientific Ritter făcea apoi același experiment, folosind în loc de electrozi de aur platină elekrodov, argint, cupru și altele asemenea. D., și separarea lor de fiecare alte bucăți de pânză, impregnate cu soluții de săruri, a primit prima secundar, t. E. capabil să doneze stocate în energie electrică, element.
Primele încercări de a crea o teorie a unui astfel de element de au făcut Volta și Marianini Becquerel, care a susținut că acțiunea bateriei depinde de soluțiile de sare de descompunere prin electrocutare în acid și alcaline, și că acesta din urmă atunci când sunt combinate, furnizează din nou un curent electric.
Această teorie a fost întreruptă în 1926 de experimentele lui Deryariv, care a folosit mai întâi apă acidificată în acumulator.
Apa acidificată în timpul trecerii curentului se descompune, evident, la oxigen și hidrogen, iar acest element se datorează acestei descompuneri prin acțiunea sa ulterioară. Această poziție a fost dovedită în mod strălucit de Grove, construindu-și faimosul acumulator de gaze, alcătuit din plăci aruncate în apă acidă și înconjurat în partea superioară: una cu hidrogen, iar cealaltă cu oxigen. Cu toate acestea, bateria în această formă a fost foarte nepractică, deoarece pentru stocarea unor cantități mari de energie electrică a fost necesar să se păstreze un număr foarte mare de gaze care ocupau un volum mare.

Plantet a luat două benzi de plumb, benzi de pânză de pânză între ele și dungi pliate în jurul unui băț rotund. Apoi pachetul rezultat a tras inele de cauciuc si a pus intr-un vas cu apa acidata. Când bateria a fost încărcată și descărcată în mod repetat, un strat activ activ a format pe suprafața plăcilor, care au participat la proces și au dat celulei o capacitate mare. Cu toate acestea, necesitatea unui număr foarte mare de încărcări și descărcări ale bateriei Plante pentru a le oferi o anumită capacitate a sporit considerabil costul bateriei și a făcut dificilă producerea.

Următoarea îmbunătățire care a adus acumulatorul la aspectul său modern a fost aplicarea în 1880 a lui Camille Faure a plăcilor de plumb cu laturi, celulele grilelor au fost umplute cu o masă special pregătită. fabricate în avans. Acest proces a simplificat și a micșorat în mare măsură fabricarea bateriilor, reducând formarea bateriei într-un proces foarte scurt.
îmbunătățiri suplimentare în istoria bateriilor plumb-acid au fost deja pe cale de a îmbunătăți metoda Faure aplicată pentru umplerea și modelarea plăcilor cu zăbrele, fără a face schimbări drastice în designul bateriei. În paralel cu dezvoltarea de baterii plumb-acid, au o serie de defecte majore și fatale, cum ar fi o mulțime de greutate pe unitate de capacitate, incapacitatea de a menține fără a se deteriora într-o stare descărcată și așa mai departe. D. A fost de a dezvolta posibilități de aplicare pentru producția de baterii și alte metale, cu excepția plumb.

Lucrările la îmbunătățirea bateriei a fost realizată de mulți oameni de știință ca Rainier, Somelinom, Darius, și alții, și în 1901 un nou tip de baterie a fost brevetat nesvintsovogo atât Edison și Yungnerom.
Această baterie este compusă din două sisteme de plăci care conțin unul din oxid de fier și un alt oxid negru Nichel, redus la 20% soluție de caustic potasiu alcalin, de obicei caustic, cu adaos de 0,5 - 1% din hidroxid de litiu.
Bateria Edison -Lalavda

Thomas Edison lângă mașina electrică - anul 1912
Elementele Edisson și Jungner au fost utilizate pe scară largă în acele cazuri în care greutatea redusă și imprevizibilitatea bateriilor sunt necesare pentru încărcare, deoarece acestea pot rămâne atâta timp cât vor într-o stare descărcată. Ei nu au reușit să înlocuiască bateriile cu plumb, totuși, atât din cauza prețului lor ridicat, cât și din cauza reculului scăzut și a tensiunii scăzute furnizate de acestea. Astfel, se alocă baterii nichel-fier, un loc important în toate unitățile portabile și mobile, în timp ce în spatele bateriilor cu plumb există un câmp larg de aplicare în instalațiile staționare.
Emtsov G. Acumulatori electrici