1. Natura fenomenului și proprietățile gazelor lichefiate
2. Metode de producere a gazelor lichefiate
3. Utilizarea gazelor lichefiate
Lista literaturii utilizate
Orice gaz poate fi transformat în lichid prin comprimare simplă dacă temperatura gazului este sub critică. Prin urmare, împărțirea substanțelor în gaze și lichide este în mare măsură condiționată. Aceste substanțe pe care le-am folosit pentru a lua de gaz, au doar o temperatură critică foarte scăzută, adică temperatură, după care gazul dobândește proprietățile lichidului, și, prin urmare, la o temperatură apropiată de temperatura camerei, nu poate fi în stare lichidă. Dimpotrivă, temperaturile critice sunt mari pentru substanțele pe care le clasificăm drept lichide.
Primul gaz (amoniac) a fost transformat în lichid deja în 1799, un progres în lichefierea gazelor asociate cu denumirea fizicianul englez M. Faraday (1791-1867), care este gaze lichefiate prin răcire simultană și compresie. A doua jumătate a secolului al 19-lea, toate cunoscute în timp ce gazele au fost nu numai șase hidrogen lichefiat, oxigen, azot, oxid de azot, monoxid de carbon și metan, - acestea sunt numite gazele permanente. Întârzierea lichefierea gazului cu un sfert de secol a avut loc, deoarece echipamentul de reducere a temperaturii a fost slab dezvoltat, iar acestea nu au putut fi răcit sub temperatura critică. Când fizicienii au învățat să obțină temperaturi de ordinul lui K, a fost posibil să se transforme toate gazele nu numai într-un lichid, ci și într-o stare solidă. [1]
Scopul acestei lucrări este de a lua în considerare natura fenomenului și a proprietăților gazelor lichefiate, precum și de a studia metodele de obținere și utilizare a acestor gaze. Tema lucrării este actuală pentru astăzi, deoarece gazele lichefiate sunt solicitate în multe domenii ale medicinei, științei și tehnologiei.
Natura fenomenului și proprietățile gazelor lichefiate
Mecanismele termice haotice continue, în care particule de orice substanță și a căror intensitate (energie) determină întotdeauna temperatura, joacă întotdeauna un rol semnificativ în toate fenomenele care apar în materie. De aceea, aproape fiecare proprietate a unei substanțe, într-un fel sau altul, depinde de temperatură, adică de intensitatea mișcărilor termice ale particulelor din ea.
Studiul proprietăților materiei la temperaturi foarte scăzute, atunci când mișcarea moleculară este slăbită, este de mare interes. Numai la temperaturi scăzute se poate investiga anumite fenomene în condiții în care fundalul constant al mișcărilor termice nu le afectează.
În studiile cu temperatură scăzută, corpul studiat este adus în contact cu corpul la o temperatură suficient de scăzută, cu așa-numitul agent frigorific. Sarcina tehnologiei cu temperatură scăzută este crearea unor astfel de agenți frigorifici. Acestea sunt, de obicei, diferite gaze lichefiate într-o stare de fierbere. Ele sunt deosebit de convenabile în faptul că contactul cu corpul răcit nu-și schimbă temperatura, ci duce doar la o evaporare mai intensă. A fost lichefierea gazelor care au deschis o regiune cu temperaturi scăzute, inclusiv cele mai scăzute temperaturi, aproape de zero.
Orice gaz poate fi transformat într-o stare lichidă, dar o condiție prealabilă pentru aceasta este pre-răcirea gazului la o temperatură sub critică. Dioxidul de bioxid de carbon, de exemplu, poate fi lichefiat la temperatura camerei, deoarece temperatura sa critică este de 31,1 ° C Același lucru se poate spune despre gaze precum amoniacul și clorul.
Dar există, de asemenea, astfel de gaze, care nu pot fi transformate în stare lichidă la temperatura camerei. Aceste gaze includ aerul (și, de asemenea, componentele sale - azot, oxigen și argon), hidrogen și heliu, în care temperaturile critice sunt mult mai mici decât temperatura camerei. Pentru a lichefia astfel de gaze, ele trebuie mai întâi să fie răcite la o temperatură ușor sub temperatura critică, după care gazul poate fi transferat într-o stare lichidă prin creșterea presiunii. Gazele lichefiate sunt depozitate mai convenabil la presiunea atmosferică (într-un vas deschis), dar în acest caz temperatura lor ar trebui să fie chiar mai mică, astfel încât presiunea să fie de 1 atm. Pentru azot, temperatura de depozitare corespunde la 77,4 K, în timp ce temperatura critică a azotului este de 126,1 K. Pentru oxigen, aceste valori sunt, respectiv, 90 K și 154,4 K pentru hidrogen 20,5 K și 33 K și pentru heliu 4 , 4 K și 5,3 K. Aceste patru gaze sunt utilizate pe scară largă practic, inclusiv ca agenți frigorifici.
Din figurile date, atât temperaturile critice cât și cele ale temperaturilor finale la care trebuie să se răcească gazele lichefiate, se poate observa că răcirea este foarte solicitantă. Pentru a obține o astfel de răcire puternică, se folosesc de obicei două metode (individual și în combinație), care vor fi discutate mai târziu. [2]
Metode de producere a gazelor lichefiate
Prima metodă de lichefiere a gazului este asociată cu utilizarea efectului Joule-Thomson. Modificarea experienței privind extinderea gazelor propuse Joule Thomson și permite de a realiza o modificare semnificativă a temperaturii gazelor, în special de răcire datorita ne-ideale, deoarece extinderea gaz ideal în gol nu este însoțită de o schimbare a temperaturii acestuia. Gazul la o presiune suficient de mare, dar constantă este forțat să curgă printr-un perete etanș izolat termic. Aceasta înseamnă că gazul curge adiabatic. Rezistența hidrodinamică a partiției conduce la faptul că o parte din presiunea gazului este pierdută pe ea și gazul părăsește compartimentul la o presiune mai mică. Gazul se extinde sau este preschimbat. O accelerație este orice dispozitiv care reprezintă rezistența la fluxul de gaze. Pentru debitul de gaz a fost constant, adică valori constante a avut loc atunci când presiunea pe ambele părți ale clapetei, necesită o pompă (compresor), care ar menține constantă presiunea. Acest compresor produce o sarcină externă de comprimare a gazelor. Acest proces de diminuare diferă de extinderea gazului într-un gol în care lucrul extern este zero. Fenomenul schimbărilor de temperatură a gazului în timpul expansiunii sale adiabatică de la o presiune constantă de ștrangulare la altul este denumit efect Joule - Thomson. Schimbarea temperaturii în gazul non-ideală în timpul Joule - Thomson explică prin faptul că expansiunea gazului crește distanța dintre moleculele și, prin urmare, lucrarea este realizată împotriva forțelor interne ale interacțiunii între molecule. Această lucrare schimbă energia cinetică a moleculelor și, în consecință, temperatura gazului. Într-un gaz ideal, unde forțele de interacțiune ale moleculelor sunt zero, nu există niciun efect Joule-Thomson.
In istoric prima masina pentru lichefierea gazelor (aer) la scară industrială (Linde și Gempson 1895 YG) pentru a răci gazele sub temperatura critică și lichefierea ulterioară utilizată metoda ștrangulare. Dăm schema mașinii Linde (1), în care, pe lângă Joule - Thomson a fost aplicat este un principiu de design important al schimbului de căldură contracurent, iar acum este utilizat în toate mașinile lichefiere.
Aerul intră în compresorul K. în care este comprimat la 200 atm. După aceasta, trece prin bobină, răcită de apă curentă, unde dă la o parte căldura eliberată în timpul comprimării. Astfel, în calea ulterioară de lichefiere, există un gaz comprimat cu o temperatură la fel ca înainte de comprimare. Acest gaz trece apoi prin bobina ab la supapa de accelerație (macara) V 1 și se extinde prin el către receptorul f la o presiune de 1 atm. Cu această expansiune, gazul este răcit oarecum, dar nu suficient pentru a deveni lichid. Gazul răcit, dar nu lichefiat, este apoi readus înapoi prin cilindrul cd. Ambele bobine, ab și cd. Acestea sunt situate relativ una față de cealaltă, astfel încât există un contact termic între ele, precum și între porțiunile de gaz care trec prin ele. Din acest motiv, gazul care a suferit expansiune și răcire răcește porțiunea de gaz comprimat care vine să o îndeplinească, care încă nu se extinde prin supapa V1. Aceasta este metoda de schimb de căldură contra-curent.
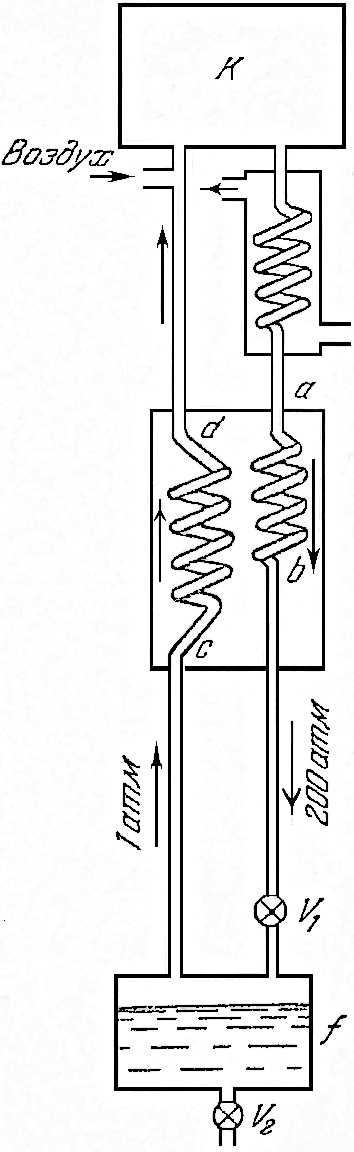
Fig.1. Schema mașinii Linde
Este clar că cea de a doua porțiune a gazului va veni la V1 valva de expansiune, având o temperatură mai scăzută decât prima, și după strangularea să scadă chiar mai mult. Astfel, un gaz din ce în ce mai rece se va apropia de supapă. După câtva timp după începerea funcționării la rece a gazului de răcire treptată mașină a fluxurilor de coliziune va duce la faptul că gazul la ștrangulare obișnuit începe să se lichefieze parțial și se acumulează în receptor, f, unde poate fi drenat prin supapa V2 într-un vas pentru stocarea gazelor lichefiate (Dewar vaselor).
În cazul procesului la starea de echilibru a mașinii care operează în diferitele sale locuri, se observă aproximativ următoarele temperaturi: la intrarea în bobina temperatura ab 293 K (cameră); la ieșirea din această bobină 170 K; după scindarea de 80 K, la intrarea în serpentina cd 80 K; la ieșirea din ea - temperatura camerei. Presiunea din fața supapei este de 200 atm, după ce jetul de 1 atm.
Dispozitivul care include atât bobinele ab și cd, în care gazul este răcit printr-un flux contracurent de gaz răcit, se numește schimbător de căldură. În mașina Linde, schimbătorul de căldură este pus în aplicare sub formă de tuburi introduse unul în altul, care împreună a fost dat forma unei bobine. Gazul de înaltă presiune curge prin tubul interior. Contra-curgerea gazului răcit de joasă presiune trece prin tubul exterior, spălând interiorul și răcind, astfel, gazul din acesta.
A doua metodă de lichefiere a gazelor se numește metoda Claude, se bazează pe metoda de extindere adiabatică. Luați în considerare diferența sa fundamentală față de metoda Linde.
Când gazul este presat, răcirea se realizează datorită lucrului intern efectuat de gaz împotriva forțelor de atracție dintre molecule. După cum se știe, răcirea cu gaz are loc și atunci când se extinde adiabatic, efectuând lucrări externe. Gazul, care se extinde și face muncă, își reduce energia internă și, prin urmare, temperatura. Acest lucru este valabil și pentru gazele ideale și pentru gazele reale. Motivul pentru răcirea gazului atunci când se lucrează extern este de a reduce vitezele moleculelor atunci când au lovit pistonul departe de ele, la care transmit o parte a energiei lor cinetice. Răcirea în timpul expansiunii adiabatică cu performanța de muncă externă pentru a fi mai eficiente decât gâtuirea, deoarece expansiunea adiabatică - un proces reversibil, în timp ce Joule - Thomson - un proces ireversibil. Și, după cum se știe, reversibilitatea proceselor din mașină oferă un coeficient de eficiență mare. Partea în care are loc extinderea gazului se numește expander.
Pentru prima dată, o astfel de mașină pentru lichefierea gazelor (figura 2) a fost construită de Claude în 1902 pentru lichefierea aerului.
metoda gazelor lichefiate
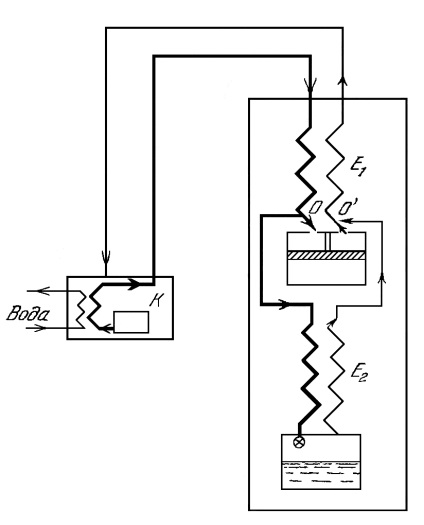
Fig.2. Schema mașinii Claude
Luați în considerare principiul de funcționare al acestei mașini. Gazul suferă o comprimare izotermică în compresorul K, de unde intră în schimbătorul de căldură E1. Aici este împărțit în două fluxuri (la punctul O). Primul trece prin E2 schimbătorului de căldură la clapeta de accelerație și este supus strangularea cu răcire, datorită efectului Joule - Thomson; Cel de-al doilea flux (80% din gazul care îl reprezintă) intră în expansor, se extinde în el, lucrează și se răcește pentru asta. Din expandor, gazul răcit este returnat la schimbătorul de căldură E1, răcind următoarea porțiune succesivă a gazului comprimat. Pentru el în punctul O, gazul care este răcit ca urmare a drosselului este atașat. Înainte de aceasta, el, trecând prin schimbătorul de căldură E2, a răcit, de asemenea, fluxul de gaze care trece. Astfel, din descrierea metodei lui Claude, se observă că răcirea într-un expander este folosită pentru pre-răcire înainte de drossel.
În prima mașină a lui Claude expansorul era o mașină cu piston. Lucrările efectuate de gazul comprimat din acesta pot fi utilizate pentru a facilita funcționarea compresorului, pentru lubrifierea forțată a mașinii etc.
Condițiile sunt tipice pentru mașini Claude (aer fluidizant) sunt aproximativ următoarele: presiunea la ieșirea din compresor 40 atm, temperatura la orificiul de intrare al expandorului (după răcire în schimbătorul de căldură E1) 200 K; temperatura după expandare într-un expander 110 K la o presiune de 1 atm.
În comparație cu metoda de răcire adiabatică, metoda bazată pe efectul Joule-Thomson are mai multă simplitate. Nu există o problemă de lubrifiere, deoarece echipamentul folosit nu conține piese în mișcare care funcționează la temperaturi scăzute. Cu toate acestea, pentru simplificare, trebuie să plătească o mare pierdere de eficiență și de necesitatea de a funcționa la presiuni ridicate, folosind cantități mari de gaz de răcire. Răcirea, care poate fi obținută prin expansiunea adiabatică, este de obicei mult mai mare decât cea care dă efectul Joule-Thomson. Dar, în același timp, există dificultăți semnificative asociate cu lubrifierea unităților mobile: la temperaturi scăzute, uleiul se îngheață. De exemplu, Claude a folosit garniturile din piele uscată uscată. Rolul lubrifierii a fost jucat de aerul însuși, care se scurge într-o mică cantitate între etanșarea pistonului și pereții cilindrilor [3].
Utilizarea gazelor lichefiate
Lichidarea gazelor este de importanță tehnică și științifică. Instalația de lichefiere a aerului este folosită în tehnologie pentru a separa aerul de componentele sale. Metoda se bazează pe faptul că diferitele gaze care alcătuiesc aerul sunt fierte la temperaturi diferite. Cele mai scăzute puncte de fierbere sunt heliul, neonul, azotul, argonul. În oxigen, punctul de fierbere este ceva mai mare decât cel al argonului. Prin urmare, primul heliu, neon, azot și apoi argon, oxigenul se evaporă.
Gazele lichefiate sunt utilizate pe scară largă în inginerie. Azotul este utilizat pentru a produce săruri de amoniac și azot, utilizate în agricultură pentru fertilizarea solului. Argon, neon și alte gaze inerte sunt utilizate pentru umplerea lămpilor electrice incandescente, precum și a lămpilor cu gaz. Cea mai mare utilizare are oxigenul. Într-un amestec cu acetilenă sau hidrogen, acesta oferă o flacără la temperatură foarte ridicată, utilizată pentru tăierea și sudarea metalelor. Injectarea oxigenului (suflare cu oxigen) accelerează procesele metalurgice. Oxigenul livrat de la farmacii în perne acționează ca un anestezic. Este deosebit de important să se folosească oxigenul lichid ca agent de oxidare pentru motoarele cu rachetă spațială.
Lichidul hidrogen este folosit drept combustibil în rachetele spațiale. De exemplu, pentru realimentarea rachetei americane "Saturn-5", este nevoie de 90 de tone de hidrogen lichid.
Lichidul amoniac a găsit o aplicare largă în frigidere - depozite imense, unde sunt stocate produse perisabile. Răcirea care are loc în timpul evaporării gazelor lichefiate este folosită în frigidere atunci când se transportă produse perisabile.
Gazele utilizate în industrie, medicină etc. sunt mai ușor de transportat atunci când sunt în stare lichefiată, deoarece în acest caz o cantitate mai mare de substanță este conținută în același volum.
În lucrarea de față, am examinat natura fenomenului și proprietățile gazelor lichefiate, precum și cele două metode principale prin care gazele sunt lichefiate. Comparând cele două metode, am constatat că cea mai simplă și mai sigură metodă de Linde, dar metoda este mai eficientă decât Claude, care este, are o eficiență ridicată, chiar dacă există o problemă cu lubrifierea pieselor în mișcare. Mai mult, au fost luate în considerare aplicațiile gazelor lichefiate. Gazele lichefiate sunt utilizate nu numai în inginerie, medicină și agricultură, dar și în știință. Cu ajutorul gazelor lichefiate, proprietățile altor substanțe sunt investigate la o temperatură apropiată de zero absolută, când mișcările moleculelor din materie sunt minime.
Lista literaturii utilizate
2. Kikoin AK Kikoin I.K. Molecular physics. M. Nauka 1976. 480 p.
3. Sivukhin D.I. Cursul general al fizicii. Termodinamica si fizica moleculara. M. Science 1979, 552 p.