Scopul acestei lucrări este:
1. Studiul metodologiei de construire a diagramei pe puncte figurative;
2. Rezolvarea problemelor practice privind schemele de echilibru pentru sistemele cu trei componente.
Principalele sarcini ale raportului sunt:
1. Construirea elementelor principale ale diagramei.
2. Studiul formei generale a diagramei sistemelor cu trei componente.
¾ definiții de bază;
¾ metoda de scădere a curbelor limită de temperatură;
¾ fazele de abandon primar și o altă cale de destrămare a cristalului;
¾ indică sfârșitul cristalizării.
Secțiunea 1 Partea teoretică
Vedere generală și elemente ale diagramei sistemelor cu trei componente
Diagrama (Figura 1) este o prismă, ale cărei margini sunt definite de respectivele scheme cu două componente și o figură spațială: concentrația componentelor depuse pe laturile unui triunghi echilateral (concentrația triunghi) și temperatură - pe perpendiculara trase pe planul triunghiului de concentrare.
În diagramă, în loc de sisteme cu trei componente ale liniilor apar suprafață liquidus, de exemplu: -E1 * A * * -R -E3 * -A * C * e2 - * E-E3 * C * V * * * -R -E1 - E2 * -B *, care sunt formate la intersecția curbelor de delimitare E1 * * -R, E2 * * E3 * -R * -R, care converg în ternar eutectic punctul E *.
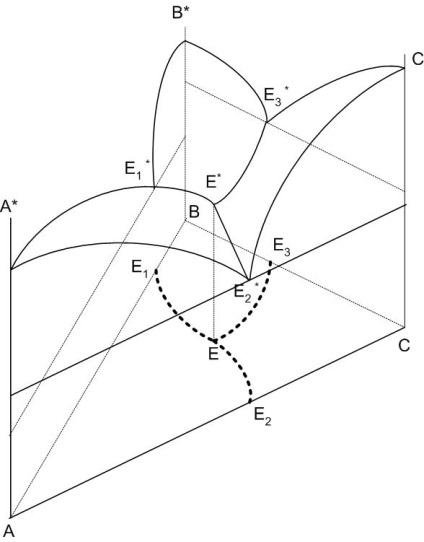
Suprafața lichusului are aceleași proprietăți ca curba lichidului: arată temperatura debutului de cristalizare (sfârșitul topirii) oricărei compoziții a sistemului; compoziția fazei lichide saturate este în echilibru cu faza solidă la o temperatură dată.
Figura 1 - Diagrama spațială a unui sistem tri-component
Liniile limită împart triunghiul de concentrație în câmpurile primare de cristalizare a compușilor existenți în sistem. Compoziția cristalelor din domeniul cristalizării primare este marcată de un cerc.
Punctele compușilor compusilor dubli sunt pe laturile triunghiului, punctele compușilor compușilor tripli chimici sunt în interiorul acestuia.
Concepte de bază ale diagramei sistemelor cu trei componente
Diagrama de proiecție este folosită pentru confortul muncii, care se formează atunci când concentrațiile tuturor elementelor diagramei spațiale sunt proiectate pe planul triunghiului. Temperatura din diagramă este prezentată în acest caz de izotermele obținute prin suprimarea diagramei spațiale de către planuri paralele cu triunghiul de concentrație la o valoare fixă a temperaturii. Adesea izotermele de pe diagrama de proiecție nu sunt afișate deloc, pentru a nu complica imaginea.
Liniile limită împart triunghiul de concentrație în câmpurile primare de cristalizare a compușilor existenți în sistem. Figura 2 -B- câmp E1 E2 - E1 E - cristalizare primară component câmp B, A- E1 - E3 E - A - componenta A și C E3 - E2 E - componenta C C.
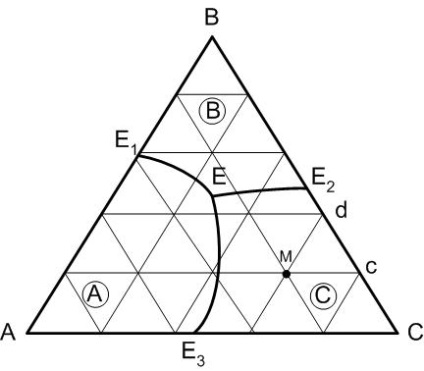
Figura 2 - Diagrama de proiectare a unui sistem cu trei componente
Punctele de compuși ai compușilor chimici sau a componentelor sistemului care au câmpuri adiacente de cristalizare primară sunt conectate prin linii drepte, numite linii drepte de legătură. Conectarea liniilor drepte împarte diagrama în triunghiuri separate, fiecare triunghi poate fi privit ca o diagramă separată a unui sistem tri-component.
Regula pârghiei în sistemul cu trei componente
Pentru un sistem cu trei componente care utilizează regula pârghiei, pot fi rezolvate următoarele sarcini:
1. Determinarea raportului cantitativ al fazelor lichide și solide în prezența unei singure faze solide.
2. Determinarea raportului cantitativ al fazelor lichide și solide în prezența a două faze cristaline cu determinarea simultană a raportului cantitativ al fazelor cristaline în compoziția fazei solide.
3. Determinarea raportului dintre două faze simultan cristalizând la un moment dat.
Reguli de bază ale diagramei sistemelor cu trei componente
Norma 1 - Metoda de aplicare a unei coborâri a curbelor limită de temperatură:
Temperatura este întotdeauna scade din punctul de intersecție al curbei de delimitare (sau extinderea acesteia), cu trunchiul (sau extensie) conectarea compozițiilor fazelor punct, câmpul de cristalizare primară, care separă această curbă limită. Pe curba de delimitare la punctul de intersecție cu trunchiul va fi temperatura maximă.
Regula 1 (Figura 3) ne permite să determinăm direcția de scădere a temperaturii pe curbele de graniță ale diagramei - va fi determinată după cum urmează. Pe E1 curba - E temperatura scade de la punctul E1 la punctul E, deoarece punctul E 1 - punctul de intersecție al liniei de conectare AB (coincident, în acest caz, cu o diagramă de proiecție laterală) și E1 curba de delimitare - E, adică E1 este un punct de temperatura maximă pentru a curbei E1-E.
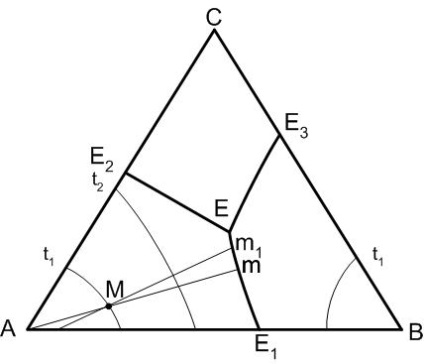
Figura 3 - Diagrama stării unui sistem tri-component cu punct triplă eutectic
Norma 2 - Determinarea fazei de abandon primar și a căii continue a degradării cristalului:
1. În timpul cristalizării topiturii, faza primară de abandonare va fi τa, în câmpul de cristalizare primară a căruia există un punct de compoziție inițială. Dacă punctul din compoziția originală aparține curbei limită, atunci fazele primare vor fi acele câmpuri de cristalizare primare pe care curba de frontieră dată împărtășește.
2. Cristalizarea dintr-o topitură a compoziției fazei solide a fazei lichide este modificată pentru a continua linia care se extinde în domeniul de cristalizare a acestei faze și trasată prin punctul fazei primare compoziției și precipitare pornind formularea punctului de temperatură descendentă.
După începerea cristalizării componentei A (Figura 3) compoziția topiturii va varia de-a lungul segmentului Mm linia A-M în direcția punctului M. De îndată ce compoziția topiturii atinge limita curba E 1 -R topitura devine suprasaturată în raport cu cele două faze solide A și B. În plus, cristalele acestor faze vor cădea simultan din topitură (gradul de libertate al sistemului este egal cu unitatea).
Parametrul termodinamică independent este de temperatură, iar compoziția topiturii va varia pe măsură ce temperatura scade în continuare puternic pe curba limită, adică de la punctul de curba M E1 -R spre punctul E. Când temperatura punctului eutectic ternar tE cristalizarea începe componenta C ca în În acest caz, topitura devine suprasaturată în raport cu cele trei componente simultan. stare invariant, caracteristic pentru acest caz termină cristalizarea completă a topiturii și în sistemul de răcire poate conduce la o răcire a celor trei faze cristaline: A, B, C. Astfel, calea de pornire compoziție cristalizare M: M → m → E. Modificarea echilibrului de fază după încălzire va fi inversată, mai degrabă decât prin răcire.
Regula 3 - Determinarea punctului final de cristalizare:
Sfârșitul cristalizării unei compoziții arbitrare a sistemului va avea loc în punctul în care se intersectează câmpurile de cristalizare primară ale fazelor situate la vârfurile triunghiului elementar, la care face parte punctul compoziției originale.
Această regulă implică faptul că toate compozițiile (a se vedea figura 4) situate în triunghiul elementar A-B-AC termina cristalizarea lor la E și produsele finale ale cristalelor de cristalizare sunt, respectiv, componentele A și B și cristalele compusului chimic AU.
Când compoziția inițială (punctul 3 din diagramă) este situat pe linia de legătură B-vorbitor, acest caz este privit ca o diagramă a sistemului de două componente în-AS la care punctul K este un punct al eutectică binar și că nu se va termina cristalizarea compoziției menționate.
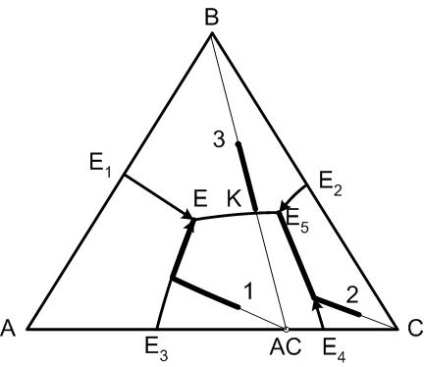
Figura 4 - Diagrama unui sistem tri-component cu un compus chimic dublu care se topește congruent
Regula 4 - Calea de cristalizare a punctului sistemului, lăsând curba incongruentă și continuând să se topească mai departe:
1. Compus chimic Double într-un sistem ternar topește cu descompunere, în cazul în care structura punct al acestui compus nu aparține domeniului său de cristalizare primară, iar acesta din urmă se învecinează diagrama de proiecție laterală pe care compoziția compusului chimic.
2. Calea de cristalizare părăsește curba incongruentă în punctul de intersecție cu continuarea liniei drepte care leagă punctul de compoziție inițială cu punctul de compoziție al compusului chimic. După aceasta, calea de cristalizare traversează câmpul de cristalizare primară a compusului chimic prin continuarea curbei de mai sus.
După topirea compus chimic descompus va aloca topitură, compoziția care este determinată de proiecția peritectic sistemul de două componente pe marginea diagramei de proiecție, adică compoziția U și cristalele (în acest caz componentul A).
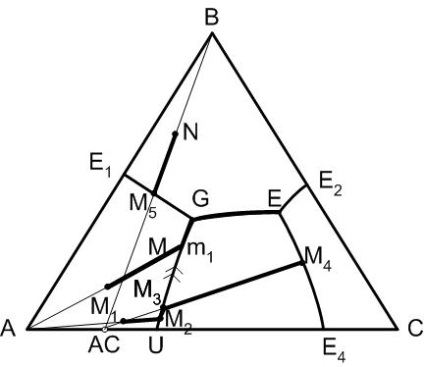
Figura 5 - Diagrama unui sistem tri-component cu dublu compus chimic topit incongruent
Punctul G din diagramă este numit punctul de ascensiune dublă. Această caracteristică diagrame punctiforme invariantă care este faptul că două adecvate la acestea curbe la limita temperatura scade până la punctul G și una dintre temperatura curbei de delimitare este coborâtă din punctul G. în continuare modul în care punctul de cristalizare al dublei ridicare capabil să termine în timp ce reducerea numărului de faze.
Secțiunea 2 Misiunea individuală
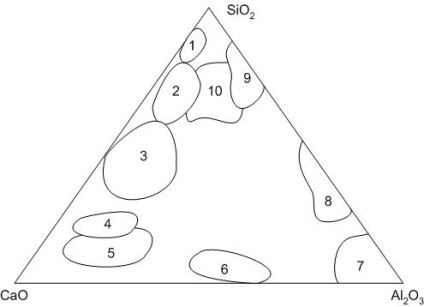
Sistem de CaO-2O 3 -SiO2 (Figura 6) joacă un rol important atât în teoria și tehnologia de producție de ciment Portland, ciment aluminos, refractare, sticlă, ceramică fină și de construcții și materiale de construcții.
Figura 6 - Zone de materiale silicate: refractare 1 - dinas; 2 - sticlă; 3 - zgură acidă; 4 - zguri de bază; 5 - Ciment Portland; 6 - ciment aluminos; 7 - refractare corindon; 8 - refractare mullite; 9 - refractare din Chamotte; 10 - porțelan
În sistem există 10 compuși chimici binari și doi compuși tripli: aluminosilicați de calciu - minerale naturale anorite și gelenite.