Principalele molecule efectoare ale răspunsului imun humoral adaptiv sunt molecule de imunoglobulină.
Structura și funcția principalelor clase de imunoglobuline
Structura imunoglobulinelor a devenit cunoscută datorită operelor lui R. Porter și G. Edelman. R. Porter a tratat preparatul IgG de iepure cu enzima papainică. Ca rezultat, au fost obținute trei fragmente, dintre care două au aceeași greutate moleculară (45 kDa) și au legat antigenul. Au fost numiți Fahl. Cel de-al treilea fragment (55 kDa), cu o structură constantă, posedă capacitatea de a cristaliza cu ușurință și a fost numit PC (Fratell cinquilary). Când molecula dei pepsină imunoglobulina Corolarului este împărțită într-un alt loc cu formarea a două fragmente: Fc-fragment și fragmentul (Fab) 2, metoda Nogo care leagă două molecule de antigen.
G. Edelman, după procesarea moleculelor de anticorpi cu mercaptoetanol, restabilind legăturile disulfidice, a determinat disocierea acestor molecule în lanțuri de proteine individuale. Pe baza acestor studii, sa propus o schemă de bază a structurii imunoglobulinelor (Figura 4-1).
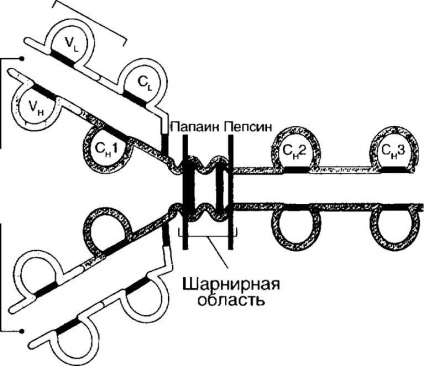
La om, se disting cinci clase de imunoglobuline: IgM, IgG, IA, 1% 0 și IgE. Imunoglobulinele din diferite clase au un plan de structură similar. Structura imunoglobulinelor este prezentată în Fig. 4-1.
molecula de imunoglobulină constă din patru lanțuri de polipeptide: două grele (H - kealu) lanțuri cu o masă moleculară de 100-120 kDa și două lanțuri ușoare (L - IF1) lanțuri cu o greutate moleculară de 50-60 kDa. Aceste lanțuri sunt combinate într-o moleculă datorită legăturilor disulfurice covalent inter-catenă (-3-3-). Fiecare lanț cuprinde o variabilă (Ui Un - Yanagimachi) domenii care determină specificitatea moleculei-immunoglobu lin și constant (C - ^ ap ^ sop5) domenii. Lanțul b are o secțiune constantă (C, -domain). Lanțul H conține trei domenii constante: CH1, CH2, CH3. Între CH1 și CH2 există o regiune de articulație constând din regiuni omoloage care includ aproximativ 110 reziduuri de aminoacizi. Componentele de carbohidrați sunt atașate într-o măsură mai mare la domeniul CH2 și oferă o gamă largă de proprietăți biologice ale noglobulinov imuno molecule (adeziune la receptorii Fc pentru lectine). Elementele principale ale domeniului sunt două straturi antiparalerale p-pliate, conectate prin una sau mai multe legături disulfidice. Această structură a domeniului de imunoglobulină a apărut precoce în evoluție și a devenit un element structural al diverși receptori din superfamilia imunoglobulinelor combinate (TSC, moleculele MHC, moleculele adge-sion, receptorii Fc, și alții.).
Când se analizează o moleculă de imunoglobulină ca antigen, se pot distinge următorii determinanți antigenici:
* izotipurile sunt determinanți care determină trăsăturile structurale ale regiunilor constante ale lanțurilor grele (izotipul este determinat de tipul lanțurilor grele). Isotipurile sunt aceleași pentru toți indivizii acestei specii;
* alotipuri - variante alelice individuale ale imunoglobulinelor într-un singur izotip, cauzate de variabilitatea domeniilor constante sau a regiunilor cadru ale domeniilor U;
* idiotipuri - determinanți antigenici, localizați în domenii variabile, care determină specificitatea moleculei de anticorp.
Situl de legare a antigenului este localizat în domeniile N-terminale ale ambelor lanțuri de imunoglobulină. Este format din domenii Vb și V și are o specificitate individuală. În domeniile variabile, se disting regiunile hipervariabile ale SOK: SBK1, SBK2, SEZ. Aceste secvențe interacționează complementar cu antigenul. Imunoglobulinele leagă diferite antigene: peptide, polizaharide, molecule de steroizi și antigene native care nu au fost supuse unui tratament prealabil. Moleculă a imunoglobulinei monomere are două centre active care leagă antigene.
Puterea de legare a unui epitop cu un situs activ de imunoglobulină se numește afinitate. Între antigen și anticorp se formează numeroase legături ne-covalente: legături hidrogen, legături hidrofobe, interacțiuni electrostatice, forțe van der Waals. Forța totală a interacțiunii întregii molecule de anticorp cu toate epitopii antigenici se numește aviditate. Locurile conservatoare (așa-numitul cadru) Y-regiunile moleculei de imunoglobulină pot lega ionii metalici, superantigeni și au activitate enzimatică.
Imunoglobulinele există în organism:
* într-o formă solubilă în sânge și alte fluide ale corpului;
* ca parte a complexelor imune (antigen-anticorp);
* în structura VSK;
* pe suprafața celulelor (macrofage, neutrofile, etc.), fixate pe receptorii Pc.
Principalele caracteristici ale imunoglobulinelor din diferite clase sunt prezentate în Tabelul. 4-1.
1§M. Moleculele IgM au o masă moleculară mare de 970 kDa și, prin urmare, penetrează prost în țesuturi. IgM constă din cinci monomeri, uniți într-o singură moleculă pentamerică prin legături disulfidice și un lanț (Figura 4-2). Structura lanțului u include patru domenii C.
În plus față de pentamer, 1M există de asemenea în formă monomerică pe membrana limfocitelor B în compoziția VSC (vezi Figura 3-20).
În timpul răspunsului imun, primii anticorpi IgM sunt produși mai întâi (vezi Figura 4-5). IgM, care a contactat antigenul, suferă modificări conformaționale, după care dobândește cea mai mare capacitate de a lega și de a activa proteinele sistemului complementar.
Principala funcție fiziologică a lui 1M este neutralizarea agenților patogeni (în principal, a virușilor) în sânge.
1C. Imunoglobulinele acestui izotop formează majoritatea anticorpilor cu un răspuns imun secundar. IgC pătrunde liber în țesuturi și este, de asemenea, singura imunoglobulină care trece prin bariera placentară. Transportul prin placentă nu este pasiv și are loc cu participarea receptorului Pc neonatal (PcKn) pentru IgG. Caracteristica PcKn este prezentată în secțiunea 3.1. Principala funcție a PcKn este de a proteja IgG de catabolism după internalizarea sa. Un astfel de mecanism asigură transportul IgG prin barierele epiteliale și endoteliale implicate în transferul de IgG de la mamă la făt. Există patru subclase ale IgC: 1C1, 1C2, 1 # C3, 1C4; diferențele în proprietățile lor
Acestea sunt enumerate în Tabelul. 4-1,1GC1 și 1GCC activează celulele complementare, fagocitele și celulele ucigașe. LgC2 și lgCl4 participă la neutralizarea directă a agenților patogeni.
CA. Există două subclase ale jurnalului A. 1 ^ A1 circulă în sânge și ajută la neutralizarea agenților patogeni prinși în sânge. Cu toate acestea, 1A1 este sensibil la acțiunea proteazelor bacteriene, de aceea joacă un rol nesemnificativ în neutralizarea agenților patogeni. IgA2 este localizat în secretele membranelor mucoase și este implicat în neutralizarea agenților patogeni care penetrează corpul în acest fel. Dimerii 1A sunt secretați de celulele plasmatice ale țesutului limfoid ne-încapsulat al membranelor mucoase, de exemplu, în Lamma proropa a intestinului. Ei se leagă apoi la receptorul de poliimmunoglobulină de pe suprafața bazolaterală a celulelor epiteliale și sunt absorbiți de endocitoză de către aceste celule. Într-o veziculă specială, acest complex este transportat prin cușcă și excretat în mucus. Componenta secretorie protejează molecula 1A de acțiunea enzimelor proteolitice (Figura 4-3).
IgA participă la formarea primei linii de protecție a membranelor mucoase. Nu activează complementul, nu are activitate bactericidă.
Structura secretorului 1dA
dar joacă un rol important în neutralizarea toxinelor bacteriene. IgA se găsește în colostru și asigură protecția imună a nou-născuților la nivelul membranelor mucoase.
Ig0 este un receptor transmembranar al limfocitelor B, funcțiile sale nu sunt cunoscute.
18E se leagă de bazofile, celulele mastocitare prin PseC1 și cauzează sensibilizarea celulelor membranelor mucoase, ceea ce duce la apariția reacțiilor alergice.
Fătul și nou-născuții vin de la mamă și dispar din serul de sânge al bebelușului cu 6-8 luni. În acest moment, sistemul imunitar al copilului începe să sintetizeze IgM și IgA. La vârsta de 1 an, nivelul de 1M propriul lor sânge de copil în aproape ajunge la nivelurile de adult, 1C - 75%, 1§A - (. Figura 4-4) 25%.
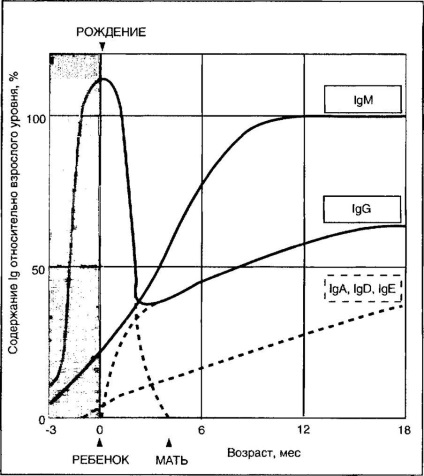
Fig. 4-4. Schimbarea cu vârsta a conținutului de imunoglobuline serice la un om (conform datelor lui Hobbs IL, 1969).
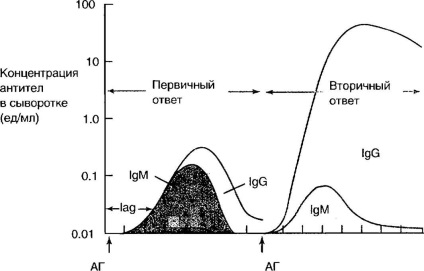
În Fig. 4-5 prezintă dinamica producerii de imunoglobuline de diferite clase în timpul administrării inițiale și repetate a antigenului. La răspunsul imun primar, cea mai mare parte a anticorpilor este reprezentată de 1M. După ingerarea repetată a antigenului în organism, cantitatea de IgM nu se modifică, clasa predominantă de imunoglobuline devine IgG. Afinitatea anticorpilor în acest caz crește semnificativ, ele apar mai repede și ajung la concentrații mari, persistă pentru o perioadă mai lungă de timp.
Mecanismele de protecție împotriva agenților patogeni, mediate de anticorpi, pot fi implementate datorită diferitelor funcții ale acestor molecule.
• Funcția antigen specifică a anticorpilor. Ca urmare a legării patogenului de centrul activ al anticorpului, se produce neutralizarea agenților patogeni și penetrarea lor în celulele organismului este împiedicată. Acest lucru se aplică în primul rând la 1M, implicat în legarea și neutralizarea toxinelor de difterie și tetanică, precum și a multor viruși. După neutralizare, agenții patogeni își pierd capacitatea de a se lega de celulele țintă, sunt îndepărtați din sânge și distruși de macrofage. dimerii 1§A se leaga de antigeni în lumenul organelor și pentru a preveni pătrunderea agenților patogeni în membranele mucoase-epite ly.
Timp după imunizare
Fig. 4-5. Dinamica producției de imunoglobuline în imunizarea primară și secundară.
Anticorpii pot, de asemenea, opsoniza bacterii și diferite celule țintă, făcându-le mai accesibile pentru fagocitoză sau citotoxicitate celulară dependentă de anticorp.
Funcțiile efectoare mediate de anticorpi Fc care interacționează cu fragmentul Fc-receptori ai celulelor înnăscute sau complement imun-theta (fig. 4-6). Dintre acestea, se disting următoarele funcții.
La activarea complementului de tip clasic și mediată de complement liza celulelor țintă (Fig. 4-6, a), de 1§M, 1§SZ, 1C1, în combinație cu un antigen interacționează cu cineva completează S4 și piesele originale legate de SZ eritrocite. Astfel, celulele roșii din sânge aduc complexe imune la ficat și splină, unde sunt fagocitoși și distruși de macrofage.
Legarea complexului „antigen-anticorp“ macrofage și neutrofile filami care exprimă receptori CSF cu ulterioara fagocitoză activelor TION și distrugerea complexului (vezi. Fig. 4-6). Citotoxicitatea celulară dependentă de anticorp (AZKTS). Celulele MK, eozinofilele, neutrofilele și alte celule exprimă PsUK de tip III (SB16). Acești receptori sunt implicați în celulele efectoare de legare prin molecule IgG la celule țintă infectate. Celulele NK declanșa perforingranzimovy mecanism de citotoxicitate și ucide celulele țintă, inducerea apoptozei în ea (fig. 4-6, C).
- Activarea celulelor în timpul interacțiunii anticorpilor cu receptorii de membrană ai membranei (Figurile 4-6, d).
Reacția de hipersensibilitate mediată de IgE. Legarea complexului antigen (alergen) cu anticorp-1E prin receptori de mare afinitate RseK1 celulele mastocite și bazofile .ini forțează o degranularea acestor celule și eliberarea de mediatori vasoactivi (histamină, L eykotrieny B4, prostaglandine) (Fig. 4-7). Acest lucru conduce la dezvoltarea reacțiilor vasculare, vasodilatația, creșterea permeabilității lor, edem contribuie la antigen și întârzierea în vatră, o împiedică să pătrundă în sânge. În plus, există o reducere intensă a mușchilor netezi, spasmul bronhiilor și a tractului digestiv.
Legarea 1§E eozinofilelor indusă de afinitate scăzută toxine eozinofilele de educație RseKN-tsiruet proteine care ucid helminths 1§E în curs de dezvoltare mediată de anticorpi citotoxicitatea adeziv precis.
În plus, anticorpii sunt capabili în unele cazuri să scindeze antigenul, i. E. au activitate enzimatică a peptidazei și a DNaza. Se știe că autoanticorpii la pacienții cu insuficiență
Anticorpii acționează ca o moleculă de mediere pentru efector
1 Imună 2 Imună 3 Celulă țintă / 4 Antigen
complex patogen complex / patogen