Tipuri de acumulatori de energie electrică
Bateriile reprezintă o parte integrantă a oricărui sistem care vizează obținerea de tipuri alternative de energie.
Cea mai mare distribuție până în prezent a fost obținută de acumulatorii electrochimici de energie electrică, în care transformarea energiei chimice în energie electrică în descărcarea unei baterii are loc printr-o reacție chimică. La încărcarea bateriei, reacția chimică are loc în direcția opusă.
Pe lângă bateriile electrochimice, energia electrică poate fi stocată în condensatoare și solenoide (bobine de inductanță).
Într-un condensator încărcat, energia este stocată ca energia câmpului electric al dielectricului. Deoarece condensatorul specific de energie stocată este foarte mică (în practică, 10-400 J / kg), iar durata posibila stocare a energiei datorită existente scurgerilor sale este mic, acest tip de stocare a energiei este folosită numai în cazurile în care este necesar să se trimită electricitate către consumator într-o foarte timp scurt, cu o durată scurtă de conservare.
În solenoid, energia electrică este acumulată sub forma energiei câmpului magnetic. Prin urmare, acest tip de unitate este numit electromagnetică. Dar timpul de alimentare cu energie electrică de către acumulatori electromagneți este de obicei măsurat nu de secunde, ci de fracțiuni de secundă.
Pentru a încărca bateria aveți nevoie de o sursă externă de alimentare și în timpul procesului de încărcare, pot apărea pierderi de energie. După încărcare, bateria poate rămâne în stare gata (în stare încărcată), dar în această stare, o parte din energie poate fi pierdută datorită împrăștierii arbitrare, a scurgerilor, a auto-descărcării sau a altor fenomene similare. Când energia este eliberată de acumulator, pot apărea și pierderi; în plus, uneori este imposibil să revenim la toată energia acumulată. Unele baterii sunt aranjate astfel încât să rămână în ele o parte din energia reziduală.
Specificațiile bateriei
Caracteristica principală a bateriei este capacitatea sa electrică. Unitatea de măsură a acestei capacități este amperi-oră (A · h) - unitate off-sistem pentru măsurarea încărcăturii electrice.
În funcție de semnificația fizică, 1 ampere de oră este o sarcină electrică care trece prin secțiunea conductorului timp de o oră cu un curent de 1 ampere în el. Un acumulator încărcat teoretic, cu o capacitate declarată de 1 A · h, este capabil să furnizeze un curent de 1 ampere timp de o oră (sau, de exemplu, 0,1 A timp de 10 ore sau 10 A timp de 0,1 ore).
În practică, capacitatea bateriei este calculată din ciclul de descărcare de 20 de ore până când tensiunea finală, care pentru baterie auto este de 10,8 V. De exemplu, inscripția de pe marcajul bateriei „55 A · h“ înseamnă că este capabil să furnizeze un curent de 2,75 amperi timp de 20 de ore și astfel tensiunea la borne nu scade sub 10,8 V.
Curentul de descărcare prea mare al bateriei are ca rezultat o ieșire energetică mai puțin eficientă, care reduce neliniar timpul de funcționare a acestuia cu un astfel de curent și poate duce la supraîncălzire.
Producătorii de baterii indică uneori capacitatea în wați ca capacitate tehnică în wați. De la 1 W = 1 A * 1, în cazul în care energia stocată este de 720 Wh putem împărți această valoare prin valoarea tensiunii (de exemplu, 12 V) și de a obține capacitatea în amperi-ore (în acest exemplu 720 W · h / 12 = 60 Ah).
Plumb-acid baterii
În starea încărcată, anodul (electrod negativ) al unei astfel de baterii constă din plumb, iar catodul (electrodul pozitiv) este fabricat din dioxid de plumb PbO2. Ambii electrozi sunt realizați din pori astfel încât zona contactului lor cu electrolitul să fie cât mai mult posibil. Proiectarea electrozilor depinde de scopul și capacitatea bateriei și poate fi foarte diversă.
Reacțiile chimice în timpul încărcării și descărcării bateriei sunt reprezentate de formula
Pb02 + Pb + 2H2S04 <—> 2PbS04 + H20
Pentru a încărca bateria, este necesară o energie teoretică de 167 W / kg. Acest număr, de asemenea, exprimă, prin urmare, limita sa teoretică pentru capacitatea specifică de stocare. Cu toate acestea, capacitatea efectivă de stocare este mult mai mică, astfel încât, de la baterie la descărcare, se obține de obicei o energie electrică de aproximativ 30 W / kg. Factorii responsabili pentru scăderea capacității de stocare sunt arătați în mod clar în Fig. 1. Eficiența unei baterii (raportul dintre energia primită în timpul descărcării și energia consumată de o încărcătură) este de obicei în intervalul de la 70% la 80%.
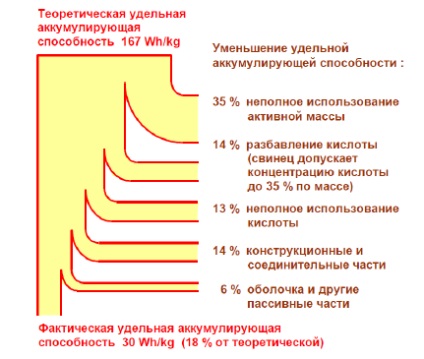
Fig.1. Capacitatea specifică de depozitare specifică și teoretică a unei baterii plumb-acid
Diverse măsuri speciale (creșterea concentrației de acid la 39%, folosind un părțile structurale din material plastic și porțiunile de legătură și al cuprului.) Au recent reușit să crească capacitatea specifică de stocare de până la 40 W • h / kg, și chiar un pic mai mare.
Din datele de mai sus rezultă că capacitatea specifică de stocare a acumulatorului de plumb (și, așa cum se va arăta mai târziu, alte tipuri de acumulatori) este semnificativ mai mică decât celulele galvanice primare. Cu toate acestea, acest defect este de obicei compensat
- posibilitatea de încărcare multiplă și, ca rezultat, aproximativ o reducere de zece ori a costului energiei electrice primite de la baterie,
- capacitatea de a face baterii cu o intensitate energetică foarte mare (dacă este necesar, de exemplu, până la 100 MW • h).
Fiecare ciclu de încărcare-descărcare este însoțit de unele procese ireversibile pe electrozi, incluzând acumularea lentă de sulfat de plumb nereducător în masa electrozilor. Din acest motiv, după un anumit număr (de obicei circa 1000) de cicluri, bateria își pierde capacitatea de încărcare în mod normal. Acest lucru se poate întâmpla în cazul neutilizării prelungite a bateriei, deoarece procesul de descărcare electrochimică (descărcare automată lentă) curge în baterie și când nu este conectat la un circuit electric extern. Acumulatorul de plumb pierde din cauza auto-descărcării, de obicei de la 0,5% la 1% din încărcătura lui pe zi. Pentru a compensa acest proces în instalațiile electrice, se utilizează o sarcină constantă la o tensiune suficient de stabilă (în funcție de tipul bateriei, la o tensiune de 2,15 V până la 2,20 V).
Un alt proces ireversibil este electroliza apei ("fierberea" bateriei) care apare la sfârșitul procesului de încărcare. Pierderea apei poate fi ușor compensată prin reîncărcare, dar hidrogenul degajat poate, împreună cu aerul, să ducă la formarea unui amestec exploziv în camera bateriei sau în compartimentul bateriei. Se recomandă o ventilare adecvată pentru a evita riscul de explozie.
Alte tipuri de baterii
În ultimii 20 de ani, au apărut baterii plumb-acid etanșate ermetic, în care nu se utilizează un lichid, ci un electrolit tip gel. Astfel de baterii pot fi instalate în orice poziție și, pe lângă faptul că în timpul încărcării nu secretează hidrogen, ele pot fi plasate în orice încăpere.
În plus față de plumb, mai mult de 50 de tipuri de baterii sunt produse, pe baza diferitelor sisteme electrochimice. La putere plantele sunt adesea folosite alcaline (cu electrolit sub formă de hidroxid de potasiu KOH) baterii nichel-fier și nichel-cadmiu, care EMF este în intervalul de 1,35 V la 1,45 V și capacitatea de stocare specifică - între 15 W • h / kg până la 45 W • h / kg. Ele sunt mai puțin sensibile la fluctuațiile temperaturii ambientale și la condițiile mai puțin solicitante de funcționare. Ei au, de asemenea, o durată de viață lungă (de obicei, de la 1000 la 4000 de cicluri de incarcare-descarcare), dar tensiunea este schimbat în timpul descărcării într-un interval mai mare decât bateriile și eficiența cu plumb acid au ceva mai mici (de la 50% la 70%).
În bateriile cu litiu-ion, anodul constă din carbură de litiu conținând carbon Lix C6 într-o stare încărcată. și catodul este realizat din oxid de litiu și cobalt Li1-x CoO2. Sărurile de litiu solide (LiPF6, LiBF4, LiClO4 sau altele) dizolvate într-un solvent organic lichid (de exemplu, în eter) sunt utilizate ca electrolit. Un agent de îngroșare (de exemplu, compuși organo-siliciu) este de obicei adăugat la electrolit, astfel încât să obțină un aspect asemănător cu gelatina. Reacțiile electrochimice în descărcare și încărcare constau în trecerea ionilor de litiu de la un electrod la altul și se procedează conform formulei
În forma externă, celulele bateriei litiu-ion pot fi plane (similare plăcilor quadrangulare) sau cilindrice (cu electrozi în role). Bateriile sunt de asemenea disponibile, în care sunt utilizate alte materiale ale anodului și catodului. Unul dintre domeniile importante de dezvoltare este dezvoltarea bateriilor cu încărcare rapidă.
Există multe alte tipuri de baterii (numai aproximativ 100). De exemplu, în sistemele de alimentare cu energie electrică ale aeronavelor, în care masa echipamentului ar trebui să fie cât mai scăzută, se utilizează acumulatori de argint-zinc cu o capacitate de stocare specifică, în medie 100 W • h / kg. Cel mai mare CEM (6.1 V) și cea mai mare capacitate de stocare specifică (6270 W • h / kg) au baterii litiu-ion, care, totuși, încă nu au producție în masă.
Celulele galvanice primare sunt foarte potrivite pentru funcționarea pe termen lung și bateriile pot fi utilizate atât pentru funcționarea pe termen lung, cât și pentru acoperirea sarcinilor pe termen scurt și jogging. Condensatoarele și inductoarele sunt utilizate în principal pentru acoperirea sarcinilor impulsive și pentru egalizarea puterii cu modificări rapide ale încărcărilor. Combinațiile de baterii cu ultracapacitoare pot fi utilizate pentru a egaliza energia furnizată rețelei de centralele eoliene și solară.
Domeniul de aplicare al unor dispozitive de acumulare prin durata sarcinii și prin puterea de ieșire este caracterizat prin Fig. 2.
