Rata reacției chimice este exprimată de obicei prin cantitatea (mol) a unuia dintre reactanți sau a produselor care au reacționat sau s-au format pe unitate de timp într-o unitate a spațiului de reacție. Sub spațiul de reacție, în cazul reacțiilor omogene, se înțelege volumul reactorului, eterogen - interfața fazelor pe care are loc procesul, catalizator eterogen - interfața sau cantitatea de catalizator.
Pentru o reacție chimică omogenă
unde V este volumul de reacție.
Rata reacției chimice poate fi măsurată prin orice componentă implicată în reacție. Este întotdeauna pozitiv, astfel încât semnul înaintea derivatului trebuie determinat dacă substanța J este reactivul inițial (apoi negativ) sau produsul (apoi pozitiv).
În cazul în care reacția are loc la un volum constant, rata este definită ca schimbarea concentrației moleculare per unitate de timp:
Dacă există un anumit coeficient stoichiometric, atunci
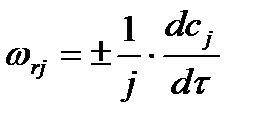
Indiferent de schimbarea cantității unui anumit reactiv sau produs, rata a fost determinată, numeric va fi aceeași, adică
Din punct de vedere experimental, rata de reacție chimică este determinată prin studierea variației de timp în cantitatea sau concentrația unui anumit reactiv sau produs.