Dr. OV Mosin
Apa este o substanță obișnuită și neobișnuită. Aproape 3/4 din suprafața planetei noastre este ocupată de oceane și mări. Apa grea - zăpadă și gheață - acoperite 20% din teren. Clima planetei depinde de apă. Geofizicii pretind că Pământul ar fi răcit de mult și s-ar fi transformat într-o bucată de piatră lipsită de viață, dacă nu pentru apă. Are o capacitate termică foarte mare. Când este încălzit, absorb aburul; răcirea, dă-o. Apa subterană absoarbe și returnează o mulțime de căldură și, prin urmare, "echilibrează" climatul. Și din frigul cosmic, Pământul protejează acele molecule de apă care sunt împrăștiate în atmosferă - în nori și sub formă de vapori.
Apa este cea mai misterioasă substanță din natură după ADN, cu proprietăți unice care nu numai că nu sunt pe deplin explicate, dar nu toate sunt cunoscute. Studiul mai lung, cu atât mai descoperim noi anomalii și mistere în ea. Cele mai multe dintre aceste anomalii, oferind posibilitatea vieții pe Pământ, sunt explicate prin prezența moleculelor de apă între legăturile de hidrogen, care sunt mult mai puternice decât van der Waals forțe de atracție între moleculele altor substanțe, ci un ordin de mărime mai slabă decât legăturile ionice și covalente între atomii în molecule. Aceleași legături de hidrogen sunt prezente și în molecula ADN.
Molecula de apă (H216O) constă din doi atomi de hidrogen (H) și un atom de oxigen (16O). Se pare că aproape toată varietatea proprietăților apei și caracterul neobișnuit al manifestării lor este determinată, în cele din urmă, de natura fizică a acestor atomi, de modul în care sunt combinate într-o moleculă și de gruparea moleculelor formate.
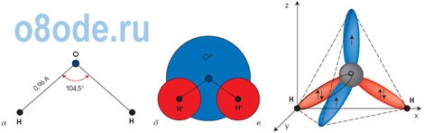
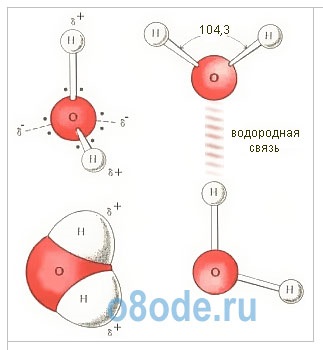
Fig. Structura moleculei de apă. Diagrama geometrică (a) un model de plat (b) și structura electronică spațială (a) monomer H2O. Doi dintre cei patru electroni cochilie exteriori ai atomilor de oxigen implicate în stabilirea de legături covalente atomilor de hidrogen, iar celelalte două formează un puternic electron alungit plan orbita, care este perpendicular pe planul H-O-H.
Moleculele de apă H2O sunt construite sub forma unui triunghi: unghiul dintre două legături de oxigen-hidrogen este de 104 de grade. Dar, deoarece ambii atomi de hidrogen sunt localizați pe o parte a oxigenului, încărcăturile electrice din acesta sunt dispersate. Molecula de apă este polară, care este motivul pentru interacțiunea specială dintre diversele sale molecule. Atomii de hidrogen din molecula H2O, având o sarcină parțială pozitivă, interacționează cu electronii atomilor de oxigen ai moleculelor învecinate. O astfel de legătură chimică se numește o legătură hidrogen. Combină moleculele de H2O în asociații specifici ai structurii spațiale; Planul în care sunt localizate legăturile de hidrogen este perpendicular pe planul atomilor din aceeași moleculă de H2O. Interacțiunea dintre moleculele de apă explică, în primul rând, temperaturile nejustificat de ridicate ale topirii și fierbei sale. Este necesar să se adune energie suplimentară pentru a se agita și apoi să se distrugă legăturile de hidrogen. Și această energie este foarte semnificativă. De aceea, capacitatea de căldură a apei este atât de mare.
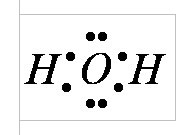
În conformitate cu structura electronică a atomilor de hidrogen și oxigen, molecula de apă are patru perechi de electroni. Două dintre ele participă la formarea legăturilor covalente cu doi atomi de hidrogen, adică sunt obligatorii. Celelalte două perechi de electroni sunt libere și nu se leagă. Formează un nor electronic. Norul nu este uniform - el poate distinge condensări separate și rarefacții.
În molecula de apă există patru poli de încărcări: două - pozitive și două - negative. Încărcările pozitive sunt concentrate la atomii de hidrogen, deoarece oxigenul este electronegativ decât hidrogenul. Doi poli negativi cad pe două perechi electronice de oxigen nelegate.
Miezul de oxigen creează un exces de densitate electronică. Perechea internă de oxigen de electroni încadrează uniform nucleul: este reprezentată schematic printr-un cerc cu centrul-nucleu O2-. Patru electroni externi sunt grupați în două perechi de electroni, gravitând către nucleu, dar parțial necompensate. Schematic, orbitele electronice totale ale acestor perechi sunt prezentate sub formă de elipse alungite de la centrul comun - nucleul O2. Fiecare din cei doi electroni de oxigen rămași formează o vapori cu un electron de hidrogen. Aceste perechi gravitează de asemenea la miezul de oxigen. Prin urmare, nucleele de hidrogen - protoni - se dovedesc a fi oarecum goale, iar aici există o lipsă a densității electronilor.
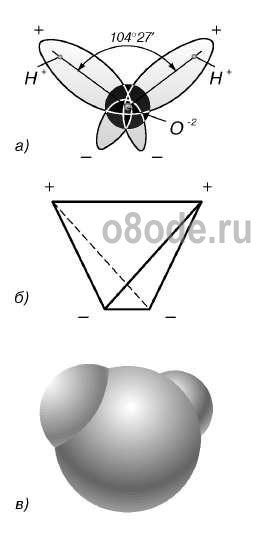
Fig. Structura moleculei de apă: a - unghiul dintre legăturile O-H; b - amplasarea polilor de încărcare; c - apariția norului de electroni al moleculei de apă.
Aproape molecula sferică de apă are o polaritate pronunțată, deoarece încărcăturile electrice în ea sunt asimetrice. Fiecare moleculă de apă este un dipol miniatural cu un moment dipol ridicat de 1,87 Debye. Debye este o unitate off-system a dipolului electric 3.33564 · 1030 Cl-m. Sub influența dipolelor de apă, forțele interatomice sau intermoleculare de pe suprafața substanței scufundate în ea scad de 80 de ori. Cu alte cuvinte, apa are o constantă dielectrică ridicată, cea mai mare dintre toți compușii cunoscuți.
În mare măsură datorită acestui fapt, apa se manifestă ca un solvent universal. Pentru efectul său de dizolvare, corpurile solide, lichidele și gazele sunt supuse într-o oarecare măsură.
Căldura specifică a apei este cea mai mare dintre toate substanțele. Mai mult, este de 2 ori mai mare decât cea a gheții, în timp ce majoritatea substanțelor simple (de exemplu metale), în căldura specifică de topire este practic neschimbată, în timp ce compușii moleculelor poliatomice este de obicei redusă în timpul topirii.
Această înțelegere a structurii moleculei face posibilă explicarea multor proprietăți ale apei, în special structura gheții. În gheața cristalină, fiecare dintre molecule este înconjurată de alte patru. Într-o imagine plană, aceasta poate fi reprezentată după cum urmează:
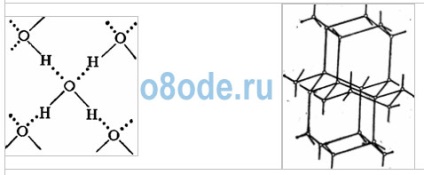
Legătura dintre molecule se realizează prin intermediul unui atom de hidrogen. Un atom de hidrogen încărcat pozitiv dintr-o moleculă de apă este atras de un atom de oxigen încărcat negativ al unei alte molecule de apă. Această conexiune a fost numită hidrogen (este desemnată prin puncte). Rezistența legăturii de hidrogen este de aproximativ 15 până la 20 de ori mai slabă decât legătura covalentă. Prin urmare, legătura cu hidrogen este ușor de rupt, care se observă, de exemplu, în evaporarea apei.
Structura apei lichide seamănă cu structura gheții. În apa lichidă, moleculele sunt, de asemenea, legate între ele prin legături de hidrogen, dar structura apei este mai puțin "dură" decât gheața. Datorită mișcării termice a moleculelor din apă, unele legături de hidrogen sunt rupte, altele sunt formate.
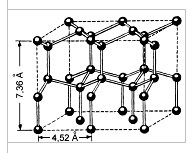
Fig. Spațiu cristalin de gheață. Moleculele de apă H2O (bilele negre) în nodurile sale sunt aranjate astfel încât fiecare să aibă patru "vecini".
Polaritatea moleculelor de apă, prezența în ele a sarcinilor electrice parțial necompensate generează o tendință de grupare a moleculelor în "comunități" mai mari - asociați. Se pare că numai apa, care este în stare de vapori, corespunde complet cu formula H2O. Acest lucru a fost demonstrat de rezultatele determinării greutății moleculare a vaporilor de apă. În intervalul de temperaturi de la 0 la 100 ° C, concentrația de molecule individuale (molecule monomere) de apă lichidă nu depășește 1%. Toate celelalte molecule de apă sunt combinate în asociați cu diferite grade de complexitate, iar compoziția lor este descrisă prin formula generală (H20) x.
Cauza directă a formării asociaților sunt legăturile de hidrogen dintre moleculele de apă. Ele apar între nucleele de hidrogen ale unor molecule și "condensările" electronice ale nucleelor de oxigen ale altor molecule de apă. Adevărat, aceste legături sunt de zece ori mai slabe decât legăturile chimice intramoleculare "standard" și suficiente din mișcările obișnuite ale moleculelor pentru a le distruge. Dar, sub influența vibrațiilor termice, apar și noi conexiuni de acest tip. Originea și descompunerea entităților asociate pot fi exprimate în următoarea schemă:
x · H2O- (H20) x
Deoarece orbitalele electronilor din fiecare moleculă de apă formează o structură tetraedrică, legăturile de hidrogen pot aranja aranjarea moleculelor de apă sub formă de asociați coordinați tetraedrici.
Cei mai mulți cercetători explică capacitatea anormal de mare de căldură a apei lichide prin faptul că atunci când gheața se topește, structura sa cristalină nu se descompune imediat. În apa lichidă, legăturile de hidrogen dintre molecule rămân. În ea rămân fragmente de gheață asociate dintr-un număr mare sau mai mic de molecule de apă. Cu toate acestea, spre deosebire de gheață, fiecare asociat nu există pentru mult timp. Există constant o distrugere a unora și formarea altor asociați. La fiecare valoare a temperaturii în apă, echilibrul dinamic este stabilit în acest proces. Și cu încălzirea apei, o parte din căldură este cheltuită pentru ruperea legăturilor de hidrogen în entitățile asociate. În același timp, 0,26-0,5 eV sunt cheltuite pentru ruperea fiecărei conexiuni. Aceasta explică capacitatea anormală de căldură a apei comparativ cu topiturile altor substanțe care nu formează legături de hidrogen. Atunci când aceste topituri sunt încălzite, energia se consumă numai pe comunicarea mișcărilor termice către atomii sau moleculele lor. Legăturile de hidrogen dintre moleculele de apă sunt complet rupte numai atunci când apa se schimbă în abur. Corectitudinea acestui punct de vedere este indicată și de faptul că căldura specifică a vaporilor de apă la 100 ° C coincide practic cu căldura specifică de gheață la 0 ° C.
Imaginea de mai jos:
Elementul structural elementar al asociatului este clusterul: Fig. Un cluster ipotetic separat de apă. Clusterele separate formează asociații ale moleculelor de apă (H2O) x: Fig. Clusterele de molecule de apă formează asociați.

Există un alt punct de vedere cu privire la natura capacității anormal de mari a căldurii apei. Profesorul GN Zatsepina a menționat că capacitatea molară de căldură a apei, care este de 18 cal / (molograd), este exact egală cu capacitatea termică molară teoretică a unui solid cu cristale triatomice. Și în conformitate cu legea lui Dulong și Petit, încălzirea atomică a tuturor corpurilor cristaline simple (monatomice) la o temperatură suficient de ridicată este aceeași și egală cu 6 calDmol o deg). Și pentru triatomic, în grammol, care conține 3 situri Na lattice, de 3 ori mai mult. (Aici, Na este numărul Avogadro).
Prin urmare, rezultă că apa este un fel de corp cristalin format din molecule triamatoase de H20. Aceasta corespunde percepția populară a apei ca amestec de asociați cristal cu cantități mici de molecule de apă libere H2O între ele, al căror număr crește odată cu creșterea temperaturii. Din acest punct de vedere, nu este surprinzător capacitatea mare de căldură a apei lichide, ci gheața solidă scăzută. Scăderea căldura specifică a apei în timpul înghețării datorită absenței vibrațiilor termice transversale ale atomilor în rețeaua cristalină a gheții rigid, unde fiecare proton provoacă legătură de hidrogen, există doar un singur grad de libertate pentru oscilații termice în loc de trei.
Dar datorită ce și cum pot să apară modificări atât de mari în capacitatea de căldură a apei fără schimbări de presiune corespunzătoare? Pentru a răspunde la această întrebare, să ne familiarizăm cu ipoteza candidatului de științe geologice și mineralogice Yu.A. Kolyasnikov asupra structurii apei.
El subliniază faptul că exploratorii chiar legături de hidrogen J. F. Bernal și Fowler 1932 g structura de apă în stare lichidă, comparativ cu structura de cristal din cuarț, și acei asociați, așa cum sa menționat mai sus, -.. Este în principal tetramers 4H20, în care patru molecule de apă sunt într-un tetraedru compact cu douăsprezece legături interne de hidrogen. Ca rezultat, se formează o piramidă tetraedrică.
În acest caz, legăturile de hidrogen din aceste tetramers pot forma atât right- și stângaci deci o secvență la fel ca și cristale de cuarț răspândite (Si02), având o structură tetraedrică sunt forme cristaline și stânga-dreapta de rotație. Deoarece fiecare astfel de tetramer al apei are de asemenea patru legături externe hidrogen neutilizate (ca într-o moleculă de apă), tetramerii pot fi conectați prin aceste legături externe într-un fel de lanțuri de polimeri, ca o moleculă ADN. Deoarece doar patru conexiuni externe și interne - de 3 ori, permite tetramerii dure și durabile în îndoită apă lichidă, rotit și chiar nadlamyvayutsya aceste vibrații termice slăbite ale legăturilor de hidrogen externe. Aceasta determină fluiditatea apei.
O astfel de structură, în opinia lui Kolyasnikov, are doar o stare lichidă și, eventual, o vapori parțiali. Dar, în structura cristalului de gheață, care a fost bine studiat, tetragidroli interconectate legături de hidrogen directe equiresistant rigide într-o structură ajurată cu goluri mari în aceasta, ceea ce face ca densitatea de gheață mai mică decât densitatea apei.

Când gheața se topește, o parte din legăturile de hidrogen din ea slăbește și se îndoaie, ceea ce duce la o restructurare a structurii în tetramerii descriși mai sus și face ca apa lichidă să fie mai densă decât gheața. La 4 ° C, o stare apare atunci când toate legăturile de hidrogen dintre tetramer sunt maxim curbate, ceea ce este motivul pentru densitatea maximă a apei la această temperatură. Comunicări suplimentare pentru a îndoi nu există loc.
La temperaturi mai mari de 4 ° C începe distrugerea legăturilor individuale dintre tetramer și la 36-37 ° C jumătate din legăturile hidrogen externe sunt rupte. Aceasta determină valoarea minimă pe curbă a căldurii specifice a apei față de temperatură. La o temperatură de 70 ° C, aproape toate legăturile intertetramerice au fost deja rupte, iar împreună cu tetramerii liberi, doar fragmente scurte de lanțuri "polimerice" din ele rămân în apă. În cele din urmă, odată cu fierberea apei, tetramerii unici sunt acum complet descompuși în molecule individuale de H20. Iar faptul că căldura specifică de evaporare a apei este exact de 3 ori mai mare decât suma încălzirii specifice a gheții topite și încălzirea ulterioară a apei la 100 ° C este o confirmare a ipotezei lui Kolyasnikov. că numărul de legături interne într-un tetramer este de 3 ori mai mare decât numărul de obligațiuni externe.