formarea legăturilor chimice este posibilă în prezența electronilor nepartiți în atom. în multe elemente nu toate electronii de la nivelul electronic extern sunt necoate.
de exemplu, în atomii de oxigen și sulf, șase electroni la nivelul exterioară, dar dintre ei numai doi nepartifuncți:
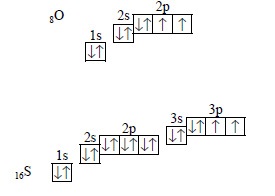
Cu toate acestea, în atomul de sulf, la atomul de sulf, la nivel de electron extern, la care se pot deplasa electroni din orbitele 3s și 3p, se află încă orbite 3d libere, rezultând atomul de sulf devenind șase electroni neparticipați:
prin urmare, valența maximă a sulfului este de șase, adică coincide cu numărul de electroni la nivelul electronic extern. în atomul de oxigen la al doilea nivel nu există d-orbitali, prin urmare nu există posibilitatea ca electronii să nu fie corelați, iar valența de oxigen nu poate fi mai mare de două, adică nu este egală cu numărul de electroni la nivelul exterior.
Problema din capitolul Capitolul 2. Dreptul periodic și sistemul periodic al lui I. Mendeleev pe baza teoriei structurii atomului. (probleme la §1-3) pe tema Chimie din cartea problemelor Chimie 11, Rudzitis, Feldman (clasa a XI-a)
Dacă nu există nicio soluție la această problemă, nu vă faceți griji. Administratorii noștri încearcă să completeze site-ul cu soluții pentru acele sarcini și exerciții unde este necesar și care nu sunt date în remake-urile și colecțiile cu GDZ. Încercați din nou mai târziu. Probabil veți găsi ceea ce căutați :)
Suntem bucuroși să vă întâmpinăm pe site-ul nostru pe studenți din toate instituțiile de învățământ de toate vârstele! Aici veți găsi remasteri și rezolvarea problemelor gratis, fără înregistrare.
davay5.com