Nu toate substanțele organice au culoare. Cu toate acestea, în acele substanțe care au o culoare, există o asemănare fundamentală în structura moleculelor. Toate acestea, ca regulă, sunt molecule mari formate din zeci de atomi. Pentru apariția culorii, nu electronii atomilor individuali contează, ci starea sistemului de electroni care cuprinde întreaga moleculă. Mobilitatea unui astfel de sistem, capacitatea acestuia de a-și schimba ușor starea sub un efect mic al quantului de lumină și determină absorbția selectivă a anumitor valuri de lumina vizibilă.
Pentru a înțelege dependența cromaticității de structură, este necesar să se ia în considerare caracteristicile stării energetice a electronilor unui anumit tip de molecule.
Spectrele de absorbție și culoarea substanțelor anorganice
Aceasta sau acea culoare a materiei înseamnă că din întregul interval de 400-700 nm al lungimilor de undă ale luminii de fierăstrău, anumite cantități sunt absorbite de ea, a cărei energie, în general, nu este foarte mare.
Din aceasta, la rândul său, rezultă că în moleculele de substanțe colorate, nivelurile de energie ale electronilor sunt destul de distanțate. În cazul în care diferența E este mare, apoi se folosesc alte cante care transportă mai multă energie, de exemplu, ultraviolete. Astfel de substanțe precum azotul, hidrogenul, fluorul, gazele nobile ne par incolore. Cuantele de lumină vizibilă nu sunt absorbite de ele, deoarece nu pot conduce electronii la un nivel mai excitat. Dacă ochii noștri ar fi putut să perceapă razele ultraviolete, atunci în lumina ultravioletă, hidrogenul și azotul și gazele inerte par să fie colorate de ea.
Cu cât mai mulți electroni dintr-un atom, cu atât sunt mai aproape de ceilalți nivelurile electronice. Este deosebit de bine dacă există orbite care nu sunt ocupate de electroni într-un atom. În acest caz, pentru tranziția unui electron dintr-o stare în alta, sunt necesare canale luminoase cu energie deja redusă, care sunt purtate de razele părții vizibile a spectrului. Astfel de halogeni multi-electroni, cum ar fi clorul, bromul, iodul, sunt deja colorate. Oxizii de azot NO2, N2O3 și compușii covalenți, de exemplu CuCI2, AlI3, sunt colorați. Colorarea moleculelor (Figura 1), formată din mai mulți atomi, depinde de un număr de factori. Dacă efectul acestor factori este de așa natură încât acestea reunesc nivelurile electronice, atunci aceasta contribuie la apariția sau aprofundarea culorii. Astfel, interacțiunea mai strânsă a atomilor în timpul tranziției de la gazos la lichid și apoi în stare solidă poate promova aspectul sau
adâncirea culorii, în special în acele cazuri în care atomii au orbite care nu sunt ocupate de electroni.
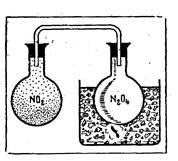
Fig. 1. Culoarea oxidului de azot (IV) dispare după răcire (se formează dimerul de N2O4) și reapare după încălzire.
Diferența dintre natura interacțiunii afectează spectrele. Spectrele de absorbție ale celor mai simple compuși moleculari - gaze și substanțe în stare gazoasă - constau din mai multe serii de benzi înguste (linii). Acest lucru înseamnă că întregul flux de lumină albă ei aleg doar câțiva fotoni a căror energie este doar egal cu diferența dintre bază și statele „excitate“ de electro-noi. Spectrul stare lichidă și în special solide devine substanțial continuu datorită interacțiunii puternice a atomilor strâns distanțate multe niveluri noi de energie electrohidraulice noi și, prin urmare, crește posibilitatea apariției unor noi tranziții electronice, numărul nivelelor de energie luni- molecule și ioni. Spectrul include un număr mare de benzi largi care se întind pe mai multe duzină de nanometri. Intensitatea benzilor și suprapunerea lor diferită determină culoarea finală a substanței. La urma urmei, cu diferite combinații de culori primare: roșu, albastru, verde sau roșu, galben, albastru, toate celelalte culori ale spectrului sunt obținute.
De regulă, benzile de absorbție a substanțelor anorganice încep în regiunea vizibilă și se termină în ultraviolet. Poziția celor mai intense benzi de absorbție determină culoarea (Tabelul 1).

Culoarea substanței constă în suma undelor reflectate (sau a trecut substanța fără întârziere), iar intensitatea acestor sau a altor valuri poate fi diferită. Prin urmare, chiar dacă spectrul constă în aceleași valuri, dar fracția lor relativă în spectru este schimbată, atunci vedem substanțe de diferite culori. Radiațiile, care se combină în spectru unul cu celălalt, vor da o culoare diferită. Iată un exemplu. Cadmiul și mercurul sunt elemente ale aceluiași subgrup al grupului II al sistemului periodic. Atomii lor diferă între ei prin numărul de electroni interni. sulfura lor HgS și CdS puternic absorbi razele capătul violet al spectrului, și mult mai slab - roșu-portocaliu (figura 2.). Ca urmare, o diferență aparent minoră în reflexie este deja obținut o combinație de: sulfură de cadmiu devine galben, și sulfura de mercur - portocaliu.
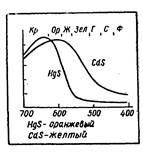
Fig.2. Diferența dintre spectrele de absorbție determină culoarea.
Diagrama prezintă spectrele mai multor substanțe, în care intensitatea reflectării undelor diferitelor părți ale luminii vizibile este diferită. În figura 3, este indicat la ce raport se vede această culoare sau acea culoare. În cazul în care curbele se intersectează, culorile se "distrug" reciproc și vedem numai culoarea care rămâne. Atunci când culoarea este reflectată cu o lungime de undă de 480 nm, substanța este albastră, deoarece culorile roșu și verde sunt distruse reciproc. La 500 nm - verde, peste 600 nm - roșu, cu o nuanță gălbuie. Sensul de culoare de la diferite ocracuri (obținut, de exemplu, atunci când se aplică stek-kol colorat) este perceput de noi ca un total.
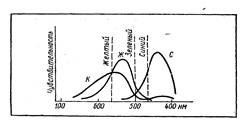
Fig. 3. Culoarea vizibilă este rezultatul impunerii culorilor primare corespunzătoare celor trei centre nervoase, creând un sentiment de roșu, verde și albastru.
Caracteristicile stării solide a coloranților anorganici
Mai întâi de toate, trebuie amintit că coloranții anorganici, atât naturali cât și sintetici, sunt corpuri cristaline. O caracteristică a acestora este aranjamentul ordonat al multor sute și mii de atomi, ioni sau molecule. Ele diferă atât în tipul de particule care intră într-un corp solid, cât și în tipul de legături chimice dintre ele.
Pentru a înțelege structura lor, trebuie să luăm în considerare exemplele caracteristicilor unuia sau a altui tip de construcție a stărilor agregate, cunoscute de cursul de chimie școlară.
În stare gazoasă, substanțele se caracterizează prin distanțe considerabile între particule și forțe mici de interacțiune dintre ele. Ei pot lua orice volum dat, iar proprietățile lor sunt în principal determinate de comportamentul particulelor individuale. În stare lichidă, particulele de substanțe sunt aduse mai aproape de distanțe proporționale cu dimensiunile lor, forțele de interacțiune dintre particule sunt semnificative. Particulele de materie se combină în agregate mari, în care ordonarea lor este ordonată, iar mișcarea are o natură oscilantă (ordine cu rază scurtă). La distanțe mari față de centrele agregatelor (comandă pe distanțe lungi) această ordonare este încălcată. Forța de legături între agregate de particule în fluidul este mică, prin urmare, substanța în stare lichidă ia o anumită cantitate, dar este capabilă să schimbe forma sub efectul gravitației. Comportamentul substanțelor în această stare este determinat atât de proprietățile particulelor și de agregatele lor, cât și de interacțiunile dintre ele.