Pentru a înțelege natura chimică a unei substanțe, este necesară cunoașterea structurii electronice a atomilor care o formează. Conform Legii periodice, proprietățile elementelor și ale compușilor formate de ele sunt determinate de încărcarea nucleelor atomilor lor. Aranjamentul elementelor chimice în sistemul periodic corespunde structurii electronice a atomilor lor.
Aceste linii directoare sunt destinate să studieze structura electronică a atomilor și să dobândească abilități în determinarea proprietăților elementelor prin localizarea lor în tabelul periodic al elementelor.
Structura atomului
având în vedere problema structurii electronice a atomilor necesar să se facă distincția între atomii liberi, care sunt înțelese ca atomi îndepărtate unele de altele, care nu interacționează unele cu altele, și atomi în solide care interacționează pentru a forma legături chimice. Pentru a înțelege natura interacțiunii lor, este necesar să se analizeze mai întâi structura electronilor atomilor liberi.
Nucleul și coaja electronică a unui atom
Fiecare atom constă dintr-un nucleu și o coajă de electroni (figura 1). Coaja de electroni a unui atom este o colecție de particule elementare - electroni, fiecare având un caracter de particule.
Electronul ca particulă are o masă de odihnă. Me = 9,1095 · 10 - 31 kg și poartă o sarcină electrică negativă egală cu 1,6022 · 10 · 19 celule. Absolut (fără a lua în considerare semnul) valoarea acestei încărcări este cea mai mică și se numește încărcătura elementară.
Atomul ca întreg nu este încărcat (electric neutru). Acest lucru se datorează faptului că suma taxelor negative ale electronilor compensa sarcina pozitiva a nucleului atomului: un atom în fiecare număr elementar de sarcini negative în shell-ul este egal cu numărul de sarcini pozitive elementare din nucleu.
Între atomii nucleu încărcate pozitiv și electroni încărcați negativ cochilia sunt electrostatice (Coulomb) gravitatea. Dimensiunea geometrică a atomului, diametrul condițional inscriptibil al cochiliei de electroni 10ˉ este de ordinul a 10 m, iar diametrul nucleului atomic - 10ˉ ordinea de 14 m, adică mărimea nucleului de 10.000 mai mică decât aceea a atomului. Rezultă că:
masa atomului este concentrată în centrul său.
In atom de hidrogen bantamweight (adica un atom de izotopi de hidrogen - protiu, al cărui miez este format dintr-un singur proton) nucleu are o masă 1,6726 · 10 27 kg electronul este mai ușor decât nucleul în 1836 de ori (de fapt, este vorba despre compararea masei unui electron și a unui proton).
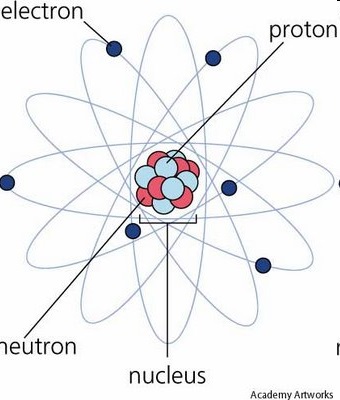
Fig. 1 Coajă de bază și electronică