ESENȚA ȘI ETIOLOGIA INFLAMMĂRII
• Inflamația - cel mai vechi și complexe vasculare răspuns Mezen-chimalnaya la prejudiciu, nu numai ca scop eliminarea agentului dăunător, dar și pentru restaurarea în leziuni tisulare.
Etiologia inflamației este variată. Poate fi vyzva-dar diferite oiologicheskimi exogenă și endogenă (virusuri, bacterii, fungi, paraziți animali, anticorpi si complexe imune), fizice (radiații și energie electrică, de înaltă și joasă evap-ry, praf și aerosoli, traumatisme multiple) și chimice (substanțe chimice, inclusiv droguri, toxine, otrăviri).
Determinarea inflamației asigură o legătură strânsă cu ambele imun (formarea de imunitate este realizată „prin inflamație“ - martor izolatoare postinfek imunitate) și regenerare (a treia fază inflamație - faza de reparare). Comunicarea cu inflamație și imunitate-neratsiey explică Rege bine devenit starea axiomatică: homeostaziei munologichesky im - o homeostazia structurală.
INFLAMAȚIE ȘI IMUNITATE -
KINETICA PROCESULUI INFLAMATOR
Conjugarea inflamației cu imunitatea pentru reparație este asigurată prin participarea tuturor sistemelor de apărare a corpului la reacția unică a vaselor terminale și a țesutului conjunctiv, care constituie esența inflamației.
După cum se știe, protecția corpului determină factori nespecifici și reactivitate imunologică sau răspuns imunitar.
Factorii de protecție nespecifici și reactivitatea imunologică [în conformitate cu Petrov, R.V. 1982]
Factori de protecție nespecifici
În formarea de imunitate in inflamatie joaca un important rol de fagocitoza ka, și sistemul complement. Se pune fagocitoza,-viespe fected de leucocite polimorfonucleare (PMN) și fagocite-mo notsitarnymi (macrofage), în sistemul imunitar este determinată de faptul că, în ciuda nespecificitatea fagocitoza AK-ta, fagocite, în special macrofagele, să ia de predare-stie in curățare antigene, procesarea acestora într-o formă imunogenă, care ia un T-helper. loc macrofage
Sistemul de imunitate este de asemenea determinat de participarea în cooperare a limfocitelor T și B necesare pentru formarea unui răspuns imunitar. Prin urmare, fagocitoza suplimentează formele de reacții ale reactivității imunologice. Sistemul complementului participă la reacții specifice, atașând componentele sale la moleculele de anticorpi, care asigură liza substanțelor antigenice împotriva cărora se produc anticorpi. Rezultă că complementul ca unul dintre factorii de apă nespecifici participă la răspunsul imun, de aceea, ca și fagocitoza, el completează formele de reactivitate imunologică. După cum se poate observa, includerea unui răspuns imun în inflamație este asigurată de două sisteme celulare de apărare nespecifică: un sistem de fagocite monocite și, de asemenea, un sistem de plasmă - un sistem complementar.
Cinetica răspunsului inflamator pentru a atinge scopul final - eliminarea agentului dăunătoare și repararea țesutului - se caracterizează printr-o schimbare a relațiilor de celule, în scopul protecției ASIC între ele și cu sistemul de țesut conjunctiv, care este determinată de reglementarea mediatorului. Din aceasta, totuși, nu rezultă că în reacția inflamatorie participă doar PLN, macro-rofagi, limfocite și fibroblaste. Celulele - purtători vazoak-tive aminele (celule mastocite, bazofile, plachete) ca și stopa-viu activitatea funcțională a eozinofile sunt de mare importanță pentru dezvoltarea adecvată a reacției inflamației vasculare. Dar nu sunt implicați în scopul principal al reacției inflamatorii - eliminarea principiului dăunător și repararea daunelor. Ca lanț, regleaza in mare masura Zamora fit inflamator de reacție în schema uni-seu: daune - + ► mediere recepție ► adeziv cooperare precisă> reparație ► transformare celulară (schema 16). Reacția inflamatorie determină, de asemenea, evoluția treptată a fazelor: 1) deteriorarea sau alterarea, 2) exudarea, 3) proliferarea și diferențierea celulelor.
Deteriorarea (modificarea) este o componentă obligatorie a inflamației. Aceasta este, inițial, ce apare o reacție co-sudisto-mezenchimală, care este esența inflamației. Este posibil să se considere modificarea ca o fază a inflamației? Această întrebare nu poate fi rezolvată fără echivoc. Unii agenți patogeni moderni IRobbins S. și colab. 1981] nu disting alterările ca atare, înlocuind-o cu perturbări ale microcirculației și proprietăților reologice ale sângelui. AM Chernukh în monografia "Inflamarea" (1979) numește prima etapă a inflamației vasculare, evidențiind două faze în ea. DS Sarkisov și VN Galankin (1988) consideră modificarea ca o componentă nespecifică a inflamației, care nu este întotdeauna obligatorie (VN Galankin) pentru dezvoltarea post-
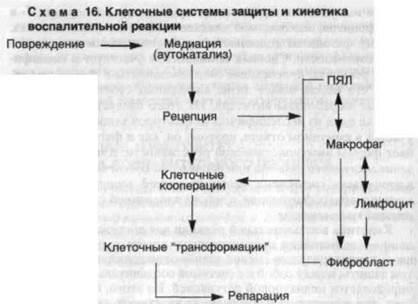
exudare și proliferare. Cu alte cuvinte, este posibil să se dezvolte inflamația fără deteriorare, iar modificarea acestei situații este înlocuită de deficiența funcțională a leucocitelor polimorfonucleare. Această poziție, chiar tolerată condiționat, exclude înțelegerea inflamației ca răspuns vascular-mezenchimic la deteriorare.
# 9632; Trebuie remarcat faptul că menținerea fazei alterative a reacției inflamatorii nu justifică izolarea formei alterative a inflamației, în care reacția vasculară-mezenchimică la leziune este practic absentă. Prin urmare, este necesar să fie de acord cu majoritatea patologilor moderni că recunoașterea inflamației alterative, distinctă de patologia clasică a trecutului, contrazice esența reacției inflamatorii în interpretarea sa modernă.
Deteriorarea și medierea sunt componente indisolubile ale morfogenezei inflamației, deoarece mediatorii se "născuiesc" în chiar daunele (alterarea).
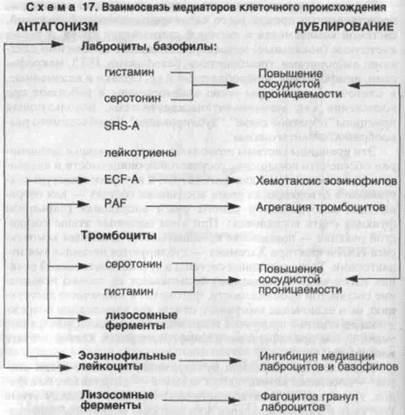
Acceptată oferă plasmă (circulant) mediatori prezentate sistem în principal kalikreina-kinin, sistemul complement și sistemul de coagulare a sângelui, precum și celule de mediatori (locale) asociate unui anumit număr de rola standuri Kami: mastocite, trombocite, bazofile, PMN, macrofage, Gami, limfocite, fibroblaste, și altele. cu toate acestea, plasmă și mediatori de celule sunt strâns legate și de a lucra in inflamatie ca un sistem autocatalitică folosind principiile „feedback-ul“, „dublarea“, „necesară în timp diversitatea“ și „antagonism ism. "
Aceste principii permit sistemului mijloci circulant rame conduce la creșterea permeabilității vasculare și chemotaxia activelor TION PMN pentru fagocitoză și intravasculară gulyatsiyu CoA în vasele eferente de la sursa de inflamație - pentru otgra-Ness agentului patogen și sursa de inflamație (inflamație a funcției de barieră a vetrei). Cu toate acestea, principalele etape ale vaselor de reacție cu stand - creșterea permeabilității, a activa PMN hemotak-Sis și factorul Hageman - Me-duplicat de mai multe diatorami. Același sistem de principii autocatalitice mediatorii de celule rea-TION nu oferă numai o permeabilitate-set mai mare vasculare, fagocitoza și destruk-TION secundar, dar includerea unui răspuns imun pentru a elimina agentul de autorizare lezate și deteriorarea produselor, și în cele din urmă țesutul de reparare prin proliferare și diferențierea celulară în inflamația.
Cel mai clar principiul exprimat dublarea curent-adezive - substanțe purtătoare vasoactive - mastocite, bazofile, trombocite și începutul antagonic - între aceste celule și leucocite eozinofile: mediatori ai celulelor mastocite și bazofile sunt stimulate chemotaxia eozinofilelor, ultimul-set ca fiind capabil inactivarea leucemie mediatori și celule fagocitoza vat mast granule (Schema 17). Printre celulele care poartă permeabilitatea vasculară me-diatory are loc „echilibru antagonică-mecanic“ originalității determinarea morfologiei fazei vasculare a inflamației, în special reacții alergice.
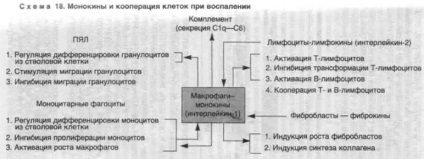
mediatori celulare - leykokiny, monokine (interleukina-1), limfokine (interleukina-2) și fibrokiny - sunt autoritățile de reglementare locale de cooperare cu celule în "câmpul" PLAYBACK-ment - PMN, macrofage, limfocite și fibroblaste [Serov VV Shekhter AB 1981]. Cu alte cuvinte, celula-turii și Medierea determină secvența de interes în SRI este inflamat-fagocitare si imunitar sisteme, pe de o parte, și firele SIS ale țesutului conjunctiv - pe de altă parte.
"Conductorul" ansamblului de mediatori celulari trebuie considerat monokine de macrofage (Schema 18). macrofage
susținute de autoreglarea mediatorului, sunt capabili să controleze monocitele prin diferențierea granulocitelor și monocitelor din celulele stem, proliferarea acestor celule, adică sunt regulatori ai fagocitozelor. Macrofagele afectează nu numai activitatea funcțională a limfocitelor T și B, participă la cooperarea lor, dar secretă și cele șase componente ale primului complement, adică mediază implicarea sistemului imunitar în răspunsul inflamator. Macrofagele induc creșterea fibroblastelor și sinteza de colagen, adică sunt stimulatori ai fazei finale a reacției reparative în inflamație. În același timp, macrofagele în sine sunt în mod obișnuit afectate de limfokine și fibrochine, adică sunt strâns legate în reglarea celulară locală cu limfocite și fibroblaste [Serov VV Shekhter AB 1981; Mayanskiy A.N. Ma-Yansky, D.N. 1983].
Recepția celulară joacă un rol imens în reglarea celulelor locale în inflamație. Cu interacțiunea ei asociate intercelulare și implicarea în componenta de inflamație a reacțiilor imune, deoarece toate celulele inflamatorii efectoare găsit imunoglobuline receptorii Fc și receptorii C-nou-complement. Deveni evident insolubilitate-bond și inegal discontinuu în timp tară sistem conjugare fagocite, sistemul imunitar și țesutul conector clorhidric sistem în obiectivul final al reacției inflamatorii (Schema 19).
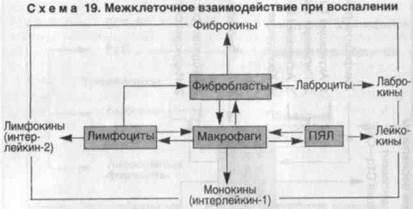
Exemple de realizare ale acestei conjugare, în funcție de caracteristicile atât agentul prejudiciabil și corpul este receptiv la eșecurile menționate ar trebui să determine cel mai probabil, dezvoltarea unei forme de inflamație. Deci, inflamație purulentă (tip inflamatie-ekssu dativ) reflectă, probabil, o formă particulară de Sopra zheniya funcțional PMN sistem falimentar cu macro-bacteriofagilor. În acest caz, macrofagele, intensificând fagocitarea PLN, devin rezistente la agentul patogen. V.E.Pigarevsky (1978), care studiază interrelaționarea este un tip special de două sisteme de fagocitoza, îl cheamă resorbtiv kletoch pe termen Resistencia. După cum se poate observa, ea reflecta ta nesosto secundare funcția elf-fagocitare a macrofagelor cu insuficiență primară PMN fagocitoza.
Alegerea primară și eșecul sistemului fagocitelor-notsitarnyh Cant, decupleze-l din sistemul PMN stau la baza inflamatie granulomatoasa (un fel de inflamație productivă). macrofage fagocitare eșec determină formarea acestor celule epitelioide și gigante își pierd funcția fagocitară-ing. Fagocitoza este înlocuită
persistența agentului patogen. Fagocitoza neterminată face însăși o reacție inflamatorie incompletă și imperfectă. Ea devine o expresie a unei reacții de hipersensibilitate de tip întârziat (HRT).
Este de asemenea evident că fiecare dintre defecte ereditare proteja tems B, ca majoritatea sistemului de țesut conjunctiv, aspectele defecte-dizolvate și răspunsul inflamator, atât în pro-forma și fluxul de fenomene, și, eventual, obiectivul final. Este suficient să amintim o deficiență ereditară a sistemelor bactericide PMN și monocite este cel mai clar pre-reprezentare la pacienții cu boală cronică granulomatoasă a copiilor, deficientele sistemului imunitar ereditare și congenitale și Fatale-Ness în procesul de creștere a le infecție purulentă, insuficiența congenitală a țesutului conjunctiv și persistența cronice inflamației-cer. Este imposibil să nu menționăm deficiențele ereditare ale sistemului complementar, în special componentele lui C3 și C5. Aceste deficite se manifestă fie ca o infecție purulentă recurentă, fie ca un sindrom asemănător lupusului. Cand inflamatia, mai ales cauzele diverși agenți vor fi trimise ca sângele circulant și getsrologichnye complexele imune locale în inflamația cronică și pot fi autologe. Astfel, în timpul inflamației există imunocomplexului de reacție - printre cele mai frecvente reacții de hipersensibilitate imediată (GNT).