CTLA-4: Cum se face sistemul imunitar să distrugă celulele canceroase
Primul grup de candidați, numit Thomson Reuters, a inclus pe James Ellison, Geoffrey Blyustoun și Craig Thompson. James Allison a dedicat toată viața lupta împotriva cancerului. Studiile în care a participat, au revoluționat tratamentul cancerului. A devenit unul dintre pionierii folosirii imunității naturale în lupta împotriva celulelor canceroase.
Cea mai mare parte a vieții celulelor sistemului imunitar, limfocite, este efectuată în explorare. Unii dintre aceștia conduc viața rezidenților în organele interne, o altă parte se mișcă în mod constant prin sistemul circulator. Pentru a se întoarce de la cercetători la războinici sau invers, limfocitele T au nevoie de un semnal chimic. În parte, limfocitele T sunt activate atunci când întâlnesc un adversar potențial, dar la începutul anilor nouăzeci a devenit clar pentru oamenii de știință că alte mecanisme de stimulare sunt importante. Semnale suplimentare la limfocite sunt furnizate de receptorii proteinei membranare. Unii îi determină pe limfocite să lupte cu anticorpi, în timp ce alții, dimpotrivă, dezactivează sau chiar o distrug. Până în prezent, există trei principali de dezactivare a proteinelor de limfocite: PD-1, CTLA-4 și TIM-3. Proteinele care elimină leucocitele din acțiune nu sunt mai puțin importante decât activatorii de proteine: fără ele, sistemul imunitar al organismului ucide chiar și celulele sănătoase. Studiul lor este principalul front al imunologiei moderne în oncologie.

Allison a creat un remediu pentru cancer, prin examinarea proteinelor membranei limfocitelor CD28, care declanșează modul „războinic“, iar proteina CTLA-4, care dezactiveaza limfocitele, prevenind distrugerea celulelor.
mare contribuție la studiul funcțiilor CD28 și CTLA-4 au Jeffrey Bluestone, și Craig Thompson: au dovedit că aceste proteine lucrează în perechi, apoi activarea, dezactivarea limfocitelor (pentru cercetările sale, sa presupus că aceste proteine sunt responsabile pentru diviziunea limfocitelor). Descoperirea lui Blyustone și a lui Thompson ia surprins pe colegi: nimeni nu se aștepta ca două proteine omoloage să se comporte atât de perfect în afară.
Ideea lui Ellison era de a "opri comutatorul" - pentru a dezactiva CTLA-4 pentru a da limfocitelor șansa de a depăși tumora de cancer. Predarea lui Ellison a fost acceptată cu mare scepticism în comunitatea științifică, dar studiile clinice au produs rezultate izbitoare: după 4 luni, mai mult de 20% dintre pacienții din grupul de pacienți tratați cu inhibitori CTLA-4 au supraviețuit. În grupul de control, nimeni nu a supraviețuit. Medicamentele dezvoltate pe baza studiilor lui Ellison, Blyustone și Thompson au salvat mii de vieți.
PD-1: Cum să nu lăsați sistemul imunitar să se odihnească
Al doilea grup de biologi care Thompson Reuters în alte laureați ai premiului Nobel, de asemenea, implicat în terapia cancerului imunitar, cu toate acestea, este deja folosind PD-1 - receptor care declanseaza programmiruemots procesul de moarte celulară.
Totul a început în anii optzeci, când biologul japonez Tasuku Hondze. Lucrările sale sunt, de asemenea, dedicate studiului muncii proteinei PD-1. În anii optzeci, Khondze a stabilit genele responsabile pentru sinteza PD-1 și și-a determinat rolul în organism: sa dovedit că această proteină este responsabilă pentru apoptoza - procesul de autodistrugere a celulelor.
Harvard biolog Gordon Freeman (omologul său omonim și doctor notoriu Half Life) angajate în aceiași receptori de proteine de limfocite T - CTLA-4 și CD28, precum și mecanisme de moarte celulară de software și PD-1. In experimentele lui Freeman, soarecii, ale caror limfocite au produs foarte putine PD-1, au murit in copilarie timpurie de multe boli autoimune. In absenta acestei proteine importante, care, la fel ca CTLA-4, dezactiveaza celulele, sistemul lor imunitar ucide toate organele și țesuturile lor.
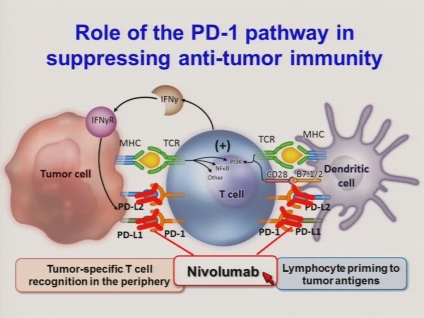
Freeman a reușit să descrie mecanismul muncii sale. Prin legarea la ligandul corespunzător PD-L1 pe suprafața limfocitelor PD, cum ar fi CTLA-4, limfocitele sunt dezactivate. În plus, PD-1 declanșează procesul de apoptoză - o moarte celulară programabilă. Un organism sănătos are uneori nevoie să-și omoare propriile limfocite - de exemplu, în timpul sarcinii, astfel încât organismul să nu dea roade pentru un organism străin care trebuie distrus. Mecanismul începe, de asemenea, în bolile autoimune, când organismul trebuie să omoare un sistem imunitar activ în mod deosebit pentru a supraviețui.
Gordon Freeman și Arlene Sharp au descoperit că celulele canceroase pot utiliza complexul PD-L1 / PD-1 pentru propriile scopuri, înșelarea organismului pentru a opri sistemul imunitar. Aproape 15 ani au trecut în dezvoltarea de medicamente bazate pe anticorpi care se leagă de PD-1 și îi împiedică să își îndeplinească funcția. Studiile clinice s-au dovedit a fi deosebit de reușite pentru pacienții cu melanom: o remisiune pe termen lung a fost observată la 40% dintre pacienți incredibilă pentru examinările oncologice. Pentru alte tipuri de cancer, medicamentele au fost puțin mai puțin, dar totuși eficiente. În multe privințe, progresul în dezvoltarea preparatelor inhibitorilor PD-1 este asociat cu decizia generoasă a lui Freeman și a lui Sharp de a-și deschide propriile modele și brevete pentru întreaga comunitate științifică. Aceasta a implicat numeroase laboratoare din întreaga lume în dezvoltarea unor astfel de medicamente.
Cum de a opri diviziunea celulară necontrolată
Totul a început cu descoperirea unei bacterii într-o probă de sol provenită din Insula Paștelui, care a produs un fungicid puternic. Substanța a fost numită rapamicină. Atunci când a fost încercat să fie utilizat pentru a trata bolile fungice la om, sa constatat că rapamicina poate deprima sistemul imunitar prin reglarea ciclului de viață al limfocitelor T. Acesta a fost utilizat în mod activ pentru a preveni reacțiile autoimune și respingerea organelor după transplant.
La începutul anilor 90 au reușit să înțeleagă cum rapamicină. De cercetare genetica a relevat faptul că, în scopul de a rapamicină nu mai funcționează, trebuie să facă „tăcere“, trei gene. produse de transcriere ale acestor gene numite „tinta al rapamicinei» (Target rapamicinei, TOR). După trei ani de studiu in drojdie de bere au fost finalizate, iar cercetatorii au apelat la obiectivul de căutare de rapamicină la mamifere. Sa dovedit a fi proteina mTOR.
Lucrarea mTOR este de a fosforila proteinele pe măsură ce sunt sintetizate pe un "transportor celular" - ribozomul. Adăugând o grupă de fosfați de atomi la aminoacizii individuali ("blocuri de construcție" ale proteinelor), mTOR este capabil să determine soarta proteinei, activitatea sau inactivitatea ei în celulă. Majoritatea proteinelor cu care lucrează mTOR sunt responsabile pentru procesele de creștere și diviziune celulară, precum și pentru procesele de metabolizare celulară. Dacă mTOR le face prea active, celulele vor începe divizarea necontrolată - transformă-te într-o tumoare canceroasă. Acum oamenii de stiinta lucreaza la preparate - inhibitori ai mTOR. Cele mai recente evoluții în acest domeniu vizează prevenirea proteinei de a obține de la molecula ATP o grupare fosfat și, prin urmare, lipsirea ei de capacitatea de a-și îndeplini sarcina de bază.