Catalaza este o enzimă găsită în aproape toate organismele vii. Funcția sa principală este de a cataliza reacția de descompunere a peroxidului de hidrogen la substanțe inofensive organismului. Catalaza este de mare importanță pentru activitatea vitală a celulelor, deoarece le protejează de distrugerea prin forme active de oxigen.
Informații generale
Enzima catalaza se refera la oxidoreductaze - o clasa vasta de enzime care catalizeaza transferul de electroni de la molecula de reducere (donator) la molecula de oxidare (acceptor).
PH-ul optim pentru catalază în organismul uman este de aproximativ 7, totuși, viteza de reacție nu se modifică semnificativ la valorile hidrogenului de 6,8 la 7,5. PH-ul optim pentru alte catalaze variază de la 4 la 11, în funcție de tipul de organism. Temperatura optimă diferă de asemenea, pentru o persoană este de aproximativ 37 o C.
Catalaza este una dintre cele mai rapide enzime. Doar o moleculă din ea poate converti milioane de molecule de peroxid de hidrogen în apă și oxigen într-o secundă. Din punct de vedere al enzimologiei, aceasta înseamnă că enzima catalazică este caracterizată printr-un număr mare de revoluții.
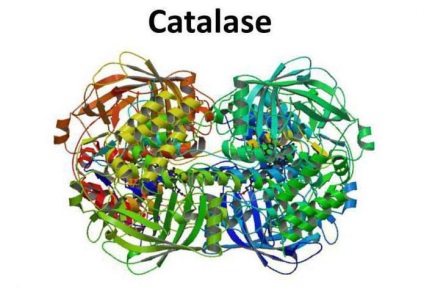
Structura enzimei
Cataliza este un tetramer al patru lanțuri polipeptidice, fiecare având o lungime de peste 500 de aminoacizi. Enzima are patru grupe de hem porfir, datorită cărora reacționează cu formele active de oxigen. Hemul oxidat este un grup protetic de catalază.
Istoria descoperirii
Catalaza nu era cunoscuta oamenilor de stiinta pana in 1818, in timp ce Louis Jacques Tenar, un chimist care a descoperit peroxidul de hidrogen in celulele vii, nu a sugerat ca distrugerea sa se datoreaza actionarii unei substante biologice necunoscute anterior.

În 1900 chimistul german Oscar Lev a introdus pentru prima dată termenul de "catalază" pentru a desemna o substanță misterioasă care descompune peroxizi. El a reușit, de asemenea, să răspundă la întrebarea în care este cuprinsă enzima catalază. Ca rezultat al numeroaselor experimente, Oscar Lev a arătat că această enzimă este caracteristică aproape tuturor animalelor și organismelor din plante. Într-o celulă vie, la fel ca multe alte enzime, catalaza este conținută în peroxizomi.
În 1937, catalaza din ficat de vită a fost cristalizată pentru prima dată. În 1938, masa moleculară a enzimei a fost determinată a fi de 250 kDa. În 1981, oamenii de știință au primit o imagine a unei structuri tridimensionale a catalazei bovine.
Cataliza peroxidului de hidrogen
În ciuda faptului că peroxidul de hidrogen este un produs al multor procese metabolice normale, acesta nu este inofensiv pentru organism.
Reacția de descompunere a peroxidului de hidrogen în țesuturile vii:
Mecanismul molecular al clivajului peroxidului de hidrogen de către enzima catalază nu a fost încă studiat temeinic. Se presupune că reacția are loc în două etape - în prima etapă, fierul din grupul protetic de catalază se leagă de atomul de oxigen al peroxidului, în timp ce se eliberează o moleculă de apă. În a doua etapă, hemul oxidat reacționează cu o altă moleculă de peroxid de hidrogen, rezultând formarea unei alte molecule de apă și o moleculă de oxigen.
Datorită acestei acțiuni a catalizei enzimei pe peroxidul de hidrogen, prezența acestei substanțe active în probele de țesut este ușor de determinat. Pentru a face acest lucru, adăugați doar o cantitate mică de peroxid de hidrogen la proba și observați reacția. Prezența unei enzime este indicată de formarea de bule de oxigen. Această reacție este bună deoarece nu necesită niciun echipament sau unelte speciale - poate fi observată cu ochiul liber.

Este de remarcat faptul că ionul oricărui metal greu poate acționa ca un inhibitor de catalază necompetitiv. În plus, toată cianura cunoscută se comportă ca un inhibitor catalazic competitiv, dacă există mult peroxid de hidrogen în țesuturi. Arsenatele joacă rolul de activatori.
cerere
Efectul degradant al enzimei catalazice asupra peroxidului de hidrogen a fost aplicat în industria alimentară - cu această enzimă, H 2 O 2 este îndepărtat din lapte înainte ca brânza să fie pregătită. O altă aplicație este ambalarea specială a produselor alimentare, care protejează produsele de oxidare. Catalaza este, de asemenea, utilizată în industria textilă pentru a îndepărta peroxidul de hidrogen din țesuturi.
Este utilizat în cantități mici în igiena lentilelor de contact. Unele dezinfectante au peroxid de hidrogen în compoziție și cataliza este utilizată pentru a descompune această componentă înainte de reutilizarea lentilelor.
activitate
Activitatea enzimei catalazice depinde de vârsta organismului. În țesuturile tinere, activitatea enzimei este mult mai mare decât în cele vechi. Odată cu vârsta, atât la oameni cât și la animale, activitatea catalazei scade treptat ca urmare a îmbătrânirii organelor și țesuturilor.
Conform unui studiu recent, o scădere a activității catalazei este una dintre posibilele cauze ale căderii părului. Peroxidul de hidrogen este format în mod constant în corpul uman, dar nu dăunează - catalaza îl descompune rapid. Dar dacă nivelul acestei enzime este redus, este evident că nu toată peroxidul de hidrogen este catalizat de enzimă. Astfel, decolorează părul din interior, dizolvă coloranții naturali. Această descoperire neașteptată este în prezent testată de cercetători și, probabil, va juca un rol în dezvoltarea medicamentelor care suspendă îngrijirea părului.
