Diferitele substanțe au structuri diferite. Dintre toate substanțele cunoscute până în prezent, există numai gaze inerte sub formă de atomi liberi (izolați), care se datorează stabilității ridicate a structurilor lor electronice. Toate celelalte substanțe (și sunt cunoscute în prezent pentru mai mult de 10 milioane) constau din atomi legați.
Notă: în caractere cursive, acele părți ale textului care nu pot fi predate și nu dezasamblate sunt evidențiate.
Formarea moleculelor de la atomi duce la un câștig energetic, deoarece în condiții normale starea moleculară este mai stabilă decât statul atomic.
Atomul la nivelul energiei externe poate conține de la unu la opt electroni. Dacă numărul de electroni la nivelul exterior al atomului este maximul pe care îl poate găzdui, atunci un astfel de nivel este numit complet. Nivelurile completate sunt caracterizate de o mare rezistență. Acestea sunt nivelele exterioare ale atomilor de gaz nobil: heliul la nivelul exterior are doi electroni (s 2), ceilalți au opt electroni (ns 2 np 6). Nivelele exterioare ale atomilor din alte elemente sunt incomplete și în procesul de interacțiune chimică sunt finalizate.
O legătură chimică se formează datorită electronilor de valență, dar se realizează în moduri diferite. Există trei tipuri principale de legături chimice: covalent, ionic și metalic.
Mecanismul formării unei legături covalente este luat în considerare, de exemplu, în formarea unei molecule de hidrogen:
H + H = H2; Q = 436 kJ
Nucleul unui atom de hidrogen liber este înconjurat de un nor de electroni sferic simetric format de un electron 1s. Atunci când atomii se apropie reciproc de o anumită distanță, o suprapunere parțială a norii lor de electroni (orbitali)
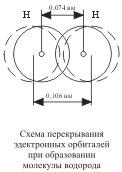
Ca urmare, un nucleu molecular de două electroni apare între centrele ambelor nuclee, care are densitatea electronică maximă în spațiul dintre nuclee; o creștere a densității încărcării negative favorizează o creștere puternică a forțelor atractive între nuclee și norul molecular.
Deci, legătura covalentă se formează ca urmare a suprapunerii nori de electroni de atomi, însoțită de eliberarea energiei. Dacă crescut mai aproape de distanța dintre atingere hidrogeni miezuri este 0,106 nm, după care se suprapun nori de electroni (formarea H2) această distanță este 0,074 nm. Cel mai mare suprapunere de nori de electroni are loc de-a lungul unei linii care leagă nucleele a doi atomi (acest lucru se întâmplă când # 963; - conectare). Legătura chimică este cu atât mai puternică, cu atât este mai mare suprapunerea orbitalilor electronici. Ca rezultat al legăturii chimice dintre cei doi atomi de hidrogen, fiecare dintre ele ajunge la configurația electronică a atomului gazului nobil al heliului.
Afișarea legăturilor chimice este adoptată în moduri diferite:
1) cu ajutorul electronilor sub forma punctelor plasate la semnul chimic al elementului. Apoi formarea moleculei de hidrogen poate fi demonstrată de sistem
H # 8729; + H # 8729; → H: H
2) adesea, în special în chimia organică, o legătură covalentă este reprezentată de o linie (de exemplu, H-H), care simbolizează o pereche comună de electroni.
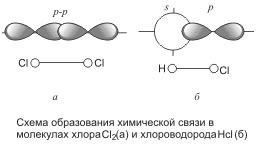
Legătura covalentă în moleculă de clor este de asemenea realizată cu ajutorul a doi electroni obișnuiți sau a unei perechi de electroni:
O pereche neagră de electroni, în atomul lor
← Perechea de electroni împărțită,
↑ ↑ în moleculă există 6.
electronul nepereche o pereche electronică comună sau divizată
După cum puteți vedea, fiecare atom de clor are trei perechi neparticipate și un electron nelegat. Formarea unei legături chimice apare datorită electronilor nepartimi ai fiecărui atom. Electronii nepermani sunt legați de o pereche obișnuită de electroni, numită și o pereche divizată.
Dacă există o legătură covalentă între atomi (o pereche electronică comună), atunci se numește singură; dacă este mai mult, apoi un dublu multiplu (două perechi electronice comune), un triple (trei perechi electronice comune).
O singură legătură este reprezentată de o singură bordură (un accident vascular cerebral), una dublă cu două liniuțe și una triplu una cu trei. O cratimă între doi atomi arată că au o pereche de electroni generalizați, rezultând o legătură chimică. Cu ajutorul acestor liniuțe se descriu formulele structurale ale moleculelor.
Astfel, fiecare moleculă într-un atom de clor a completat nivelul său exterior de opt electroni (s 2 p 6), două dintre ele (pereche de electroni) aparțin în mod egal ambii atomi. Suprapunerea orbitalelor electronice în timpul formării moleculei este prezentată în Fig.
Într-o moleculă de azot, atomii de N2 au trei perechi comune de electroni:
Evident, o moleculă de azot este mai puternică decât o moleculă de hidrogen sau clor, care este responsabilă de inerția considerabilă a azotului în reacțiile chimice.
Legătura chimică, realizată prin perechi de electroni, se numește covalentă.
Mecanisme de formare a legăturii covalente.
O legătura covalentă este formată nu numai prin suprapunerea norii cu un electron, este mecanismul de schimb pentru formarea unei legături covalente.
Cu un mecanism de schimb, atomii furnizează același număr de electroni în uz comun.
Este posibil și un alt mecanism de formare: donator-acceptor. În acest caz, legătura chimică rezultă din perechea de electroni neparticipați dintr-un atom și din orbitele libere ale unui alt atom.
Să luăm în considerare, ca exemplu, mecanismul de formare a ionului de amoniu NH4 +
În interacțiunea amoniacului cu HCI apare o reacție chimică:
NH3 + HCI = NH4CI sau sub formă ionică redusă: NH3 + H + = NH4 +
Într-o moleculă de amoniac, atomul de azot are o pereche de electroni neparticipați (un nor electron cu două electroni):
Ionul de hidrogen este liber (nu este umplut) cu orbita 1s, care poate fi desemnat ca # 9633; H +
În formarea de ioni de amoniu se suprapun orbitală se produce un atom de azot ocupat perechea de electroni unshared cu un orbital gol de ioni de hidrogen (nor doi electroni devine azot comun la atomii de azot și hidrogen, adică este convertit în nor de electroni molecular). Deci, există o a patra legătură covalentă. Procesul de formare a ionului de amoniu poate fi reprezentat de schema:
Acuzația de ioni de hidrogen devine comun (ea delocalizat, adică dispersate între toți atomii) și nor doi electroni (singură pereche de electroni), care aparține azotul devine comun cu hidrogen. În diagrame, imaginea celulară # 9633; de multe ori omise.
Un atom care oferă o pereche de electroni neparticipați este numit donator, iar un atom care o ia (adică, oferă o orbitală liberă) se numește acceptor.
Mecanismul de formare a legăturii covalente din cauza norului doi electroni unui atom (donor) și un orbital liber al unui alt atom (acceptor) este un donor-acceptor. Legătura covalentă formată în acest fel se numește legătura donor-acceptor.
Cu toate acestea, aceasta nu este un tip special de conexiune, ci doar un mecanism diferit (metoda) pentru formarea unei legături covalente. Prin proprietăți, a patra legătură N-H din ionul de amoniu nu este diferită de celelalte trei.