Coroziunea chimică și electrochimică. Procesele anodice și catodice în coroziunea electrochimică. Coroziunea electrochimică cu depolarizarea cu hidrogen și oxigen. Coroziunea la contactul metalelor diferite. Principalele modalități de a proteja structurile metalice împotriva coroziunii. Acoperiri metalice anodice și catodice. Metode electrochimice de protecție-protecție, protecție catodică.
Coroziune - distrugere nedorită spontană a metalului ca urmare a interacțiunii sale cu mediul.
În cazul coroziunii, metalul (agentul reducător) este oxidat de oxidant, care este o componentă a mediului, adică coroziunea este un proces de reducere a oxidării.
Prin mecanismul procesului de coroziune, substanțele chimice și electrochimice sunt izolate la orroziune.
Coroziunea chimică are loc într-un mediu non-electrolitic prin tranziția directă a electronilor de la atomii de metal la oxidant. Cele mai obișnuite tipuri de coroziune chimică sunt coroziunea și coroziunea gazului în mediu non-electrolitic (benzină, ulei, solvenți organici).
Coroziunea gazului se observă în gaze agresive (clor, oxigen, oxizi de sulf, azot) și vapori fără condens de umiditate pe suprafața metalului, de obicei la temperaturi ridicate. Acest tip de coroziune este supus la unelte de tăiere, lame de turbină cu gaz, părți ale motorului cu jet.
Un exemplu de coroziune într-un mediu non-electrolitic este coroziunea în combustibil lichid (distrugerea părților motoarelor cu combustie internă etc.).
Coroziunea electrochimică are loc într-un mediu electrolitic, diferența fiind separarea proceselor de oxidare și de reducere în spațiu. Acest tip de coroziune este mai frecvent, este expus structurilor metalice în sol, râu și ape de mare, în soluții de săruri, acizi, alcalii, în atmosferă sub filme de umiditate adsorbite etc. Coroziunea electrochimică apare atunci când există o diferență de potențial între suprafețele metalice.
Principalele cauze ale coroziunii electrochimice (apariția unei diferențe de potențial)
contactul cu metale diferite,
microstres într-un produs metalic,
eterogenitatea tratamentului mecanic sau termic al suprafeței metalice,
prezența incluziunilor nemetalice și a impurităților (grafit, carburi, pete de vopsea la suprafață etc.);
diferența de temperatură a suprafețelor metalice.
Abilitatea unui metal de a rezista la medii corozive se numește rezistență la coroziune. Rezistența la coroziune este determinată calitativ și cantitativ - prin rata de coroziune în condițiile date, printr-un grup sau printr-un scor de rezistență în conformitate cu scala adoptată. Metalele cu rezistență ridicată la coroziune sunt numite rezistente la coroziune.
Procesele anodice și catodice în coroziunea electrochimică
În timpul coroziunii electrochimice se disting două procese interdependente: anodice și catodice.
Procesul anodic - oxidarea metalului, are loc pe părțile produselor cu un potențial mai scăzut în mediul dat. Locurile anodice sunt distruse.
Procesul catodic - reducerea oxidantului în soluția sau topirea electrolitului are loc în zonele cu produse cu un potențial mai mare într-un mediu dat. Siturile catodice nu se schimbă chimic. Acestea servesc drept conductori de electroni din zonele anodice către oxidant, mărind astfel coroziunea regiunilor anodice. Acest lucru va fi discutat în detaliu mai jos pe exemple specifice.
Oxidatorii pentru coroziune sunt de obicei denumiți depolarizanți. Coroziunea care implică cei mai obișnuiți oxidanți - oxigenul dizolvat și ionii de hidrogen (acid sau apă) se numește în mod corespunzător coroziune cu depolarizarea oxigenului și a hidrogenului. Ecuațiile proceselor catodice sunt prezentate în tabel.
Ecuațiile procesului catodic în coroziune
Proprietățile oxidante ale oxigenului sunt mai mari decât proprietățile oxidante ale ionului de hidrogen (sau a apei). În prezența oxigenului din soluție, coroziunea nu va fi neapărat datorată depolarizării oxigenului, deoarece concentrația de oxigen dizolvat este în general mică. S-a constatat că la pH7, adică în soluții neutre și alcaline, procesul se desfășoară de obicei cu depolarizarea oxigenului - ecuația (4), în mediu acid - în principal cu depolarizarea hidrogenului - ecuația (1).
Coroziunea, ca orice proces de oxidare-reducere, poate fi efectuată numai cu condiția ca potențialul oxidantului să fie mai mare decât potențialul agentului reducător (metalul secțiunilor anodice).
Coroziunea la contactul metalelor diferite
Unul dintre cazurile cele mai frecvente de coroziune electrochimică sunt procesele care apar atunci când două metale sunt în contact în soluția de electrolit. O astfel de pereche de metale (M1 și M2) se numește galvano-vapori și se notează M1 / M2.
O descriere simplificată a procesului de coroziune care implică galvanoide este efectuată în mod succesiv în următoarea secvență.
Scrieți valorile potențialelor metalelor într-un mediu dat, determinați anodul (metalul - cu o valoare mai mică a potențialului) și catodul (metalul - cu o valoare mai mare a potențialului).
Notați potențialul unui posibil oxidant (depolarizator).
Evaluați posibilitatea procesului prin compararea potențialului oxidantului și a agentului reducător.
Scrieți ecuațiile de reacție:
oxidarea anodică a materialului anodic;
reducerea catodică a oxidantului.
Rezumați ecuațiile reacțiilor de jumătate, scrieți ecuațiile ionice și moleculare ale reacției de reducere a oxidării care se desfășoară în timpul galvanocorrozei.
Pentru a arăta direcția deplasării electronilor pe schema de pereche galvanică convențională.
Luați în considerare procesul de coroziune al fierului (acoperit cu fier), cu condiția ca continuitatea acoperirii să fie perturbată într-un mediu acid în absența oxigenului dizolvat.
Dacă se întrerupe continuitatea acoperirii, se formează galvano-vapori, schema sa condiționată
Valorile potențialelor metalelor
Fe - anod de vapori galvanici (A) - agent reducător, este oxidat;
Sn este catodul unei perechi galvanice (K).
Oxidantul posibil - ioni de hidrogen ai acidului,
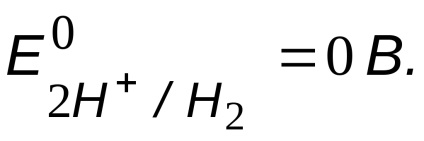
Compararea potențialului agentului oxidant și a agentului reducător
, și anume coroziunea fierului este posibilă.
A: Fe - 2 2 = Fe 2+ - oxidare
K (Sn): 2H + + 2e = reducere de H2
Ecuații ionice și moleculare:
Fe + 2H + = Fe2 + + H2
Direcția mișcării electronilor pe schema de pereche galvanică convențională (de la un sit cu potențial mai mic la un sit cu potențial mai mare):
În galvanopar, fierul de staniu într-un mediu acid distruge fierul, hidrogenul este eliberat pe staniu.
Luați în considerare procesul de coroziune cu depolarizarea oxigenului în aer umed de vapori galvanici de Mg / Fe.
Diagrama condiționată a perechii galvanice
Valorile potențialelor metalelor
.
Mg - anod de vapori galvanici (A) - agent reducător, este oxidat.
Fe este catodul unei perechi galvanice (K).
Agent de oxidare pentru coroziunea cu depolarizarea oxigenului - oxigen ,.
A: 2 Mg + 2H20 - 2e = Mg (OH) 2 + 2H + - oxidare
K (Fe): 1 02 + 2H20 + 4S = 4OH - reducere
2Mg + 4H2O + 02 + 2H20 = 2Mg (OH) 2 + 4H + + 4OH
Direcția mișcării electronilor pe schema de pereche galvanică convențională:
La contactul metalelor diferite, metalul mai activ suferă oxidare, este distrus. Contactul cu un metal mai puțin activ mărește coroziunea celui mai activ metal. Contactul cu un metal mai activ protejează metalul mai puțin activ de deteriorarea coroziunii.
Metode de protejare a metalelor împotriva coroziunii
lacuri, vopsele, smalțuri, bitum, materiale plastice, ceramică, cauciuc, rășini și alte acoperiri aplicate prin metode fizice;
oxid, fosfat și alte filme obținute prin tratarea metalelor cu substanțe chimice.
Acoperiri anodice - acoperiri de produse cu un metal mai activ, adică un metal cu un potențial mai scăzut într-un mediu dat decât potențialul metalului acoperit, de exemplu, fier galvanizat.
Acoperirile cu catod sunt acoperiri ale unui articol cu un metal mai puțin activ, adică un metal cu un potențial mai mare într-un mediu dat decât potențialul metalului acoperit; exemple sunt placarea cu cupru, placarea cu nichel a oțelului.
Schemele de procese care apar în pori sau când continuitatea acoperirilor metalice sunt perturbate sunt arătate în figură.