Toate metalele și aliajele metalice, cu rare excepții în stare solidă, sunt corpuri cristaline, atomii (ionii) sunt aranjați în metale în ordine relativ unele de altele la anumite distanțe în funcție de natura metalului. Aceste distanțe sunt numite parametrii laturii cristalului.
În corpurile amorfe, atomii nu sunt aranjați într-un mod ordonat, ci sunt haoți.
Metale dacă sunt cristalizate într-o manieră convențională - corp policristalin constând dintr-un număr mare de mici, disting numai în boabe de microscop (10 -1 10 -6 cm) și variat orientate în raport unul cu altul.
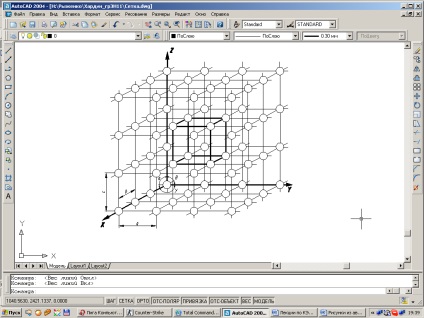
În consecință, fiecare granulă a unui metal constă dintr-un set de astfel de corpuri geometrice, numite celule elementare. În granulele metalice vecine, aceste celule sunt orientate diferit.
Fig. 1.1. Schema zăbrelelor de cristal.
Atomii din nodurile rețelei de cristal fluctuează în raport cu poziția lor medie la o frecvență de aproximativ 10 13 Hz, fără a părăsi locul lor, cu excepția unor cazuri speciale.
Ce păstrează atomii la nodurile laturii cristaline, păstrând natura stării solide a materialului și puterea lui.
Se știe că atomul din orice metal constă din mai multe cochilii electronice care îl înconjoară, care poartă o sarcină negativă. Fiecare coajă este umplută cu un număr strict definit de electroni legați puternic de atom și numai pe ultima coajă, există mai mulți electroni cuplați liber cu atomul. Numărul lor este egal cu valența metalului. Cu ajutorul acestor electroni, atomii din legătura metalică unul cu celălalt. Conectarea atomilor între ele folosind electroni de valență se numește metalică.
Dar nu toți electronii din cochilia exterioară participă la formarea unei legături interatomice metalice. Unii electroni, care părăsesc nucleul atomilor lor, intră în spațiul interstițial, formând un "gaz" electronic, adică deveniți colectivizați.
Datorită electronilor colectivizați, metalele au conductivitate electrică și termică, strălucire metalică, supraconductivitate, emisie termionică, deformare plastică și alte proprietăți metalice.
Forța de legare a metalelor este determinată de forțele de repulsie și atracție dintre ioni și electroni. Atomii (ionii) sunt localizați la o distanță atât de mare una față de cealaltă, la care energia de interacțiune este minimă.
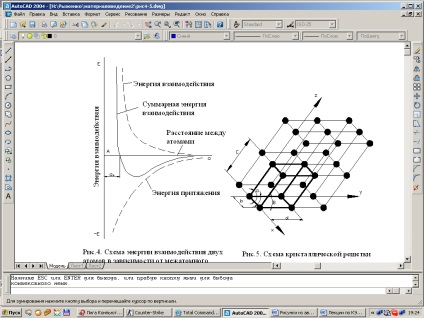
Majoritatea metalelor formează una dintre următoarele grătare cu simetrie înaltă
Fig. 1.2. Schema energiei de interacțiune a doi atomi ca o funcție a distanței interatomice.
ambalarea densă a atomilor (Figura 1.3).
a, b) centralizarea volumului cubic (bcc) - rețeaua are fier în condiții normale de temperatură, crom, tungsten, vanadiu, molibden, potasiu, sodiu;
c) zăbrele cubice (fcc) are nichel, cupru, aluminiu, plumb, argint, fier la temperaturi de 911-1392 ° C și alte metale;
d) o rețea hexagonală închisă (hcp) are magneziu, zinc, cobalt, zirconiu și titan la temperatura camerei.
Pentru a caracteriza în mod unic o latură de cristal elementară, adică parametrii săi, trebuie să știți: trei margini (a, b și c) și
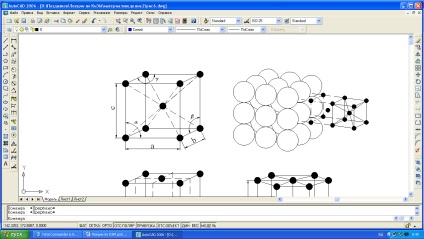
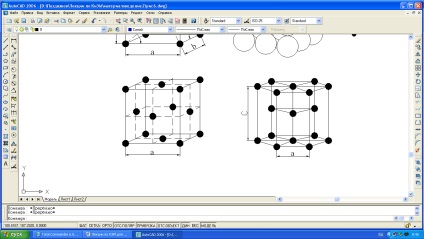
Fig. 1.3. Grile de cristal din metale: a și b - centrată pe corp (bcc); c - centrul centrat pe față (fcc); g - hexagonală închisă.
trei unghiuri între axe (# 945; # 946; și # 947;) (vezi Figura 1.1). Parametrii sunt distanțele dintre centrele atomilor învecinați în direcția aleasă și sunt măsurate în nanometri sau Angstromi A °, cu 1 nm = 10 A ° = 10-9 m.
După cum se poate observa, unele metale, în funcție de condițiile de temperatură, există cu diferite laturi cristaline. De exemplu, fierul, la temperaturi de pana la 911 ° C are un grilaj bcc, peste 911 ° C și până la 1392 ° C are o rețea cubică cu fețe centrate și mai departe peste 1392 ° C până la temperatura de topire de 1539 ° C, ia forma unui grilaj bcc.
Abilitatea unui metal de a schimba tipul de latură cristalină în funcție de temperatură se numește alotropie sau polimorfism.
Transformările polimorfe au valori importante în tehnologie, datorită acestora, este posibilă producerea unui tratament termic al oțelurilor și al altor metale.
Este ușor de observat că densitatea atomilor din rețeaua cristalului de-a lungul diferitelor planuri nu este aceeași (Figura 1.4).
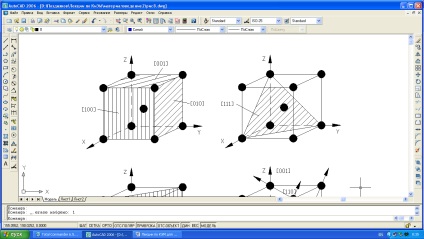
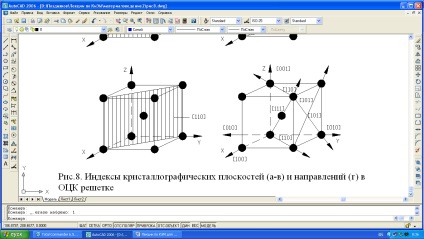
Fig. 1.4. Indicii planurilor cristalografice (a-c) și direcțiile (d) din rețeaua bcc.
Deoarece (100) plane într-un grilaj bcc aparține atomul (1 / 4x4 = 1), planul (110) - 2 atomi (1 / 4x4 + 1 = 2), apoi datorită densității inegale în planuri diferite și direcții de zăbrele, proprietăți ( chimice, fizice, mecanice) fiecărui singur cristal vor fi inegale și acest lucru se numește anizotropie. Prin urmare, cristalul este un corp anisotrop.
Metalele tehnice sunt corpuri policristaline, adică constau dintr-un număr mare de cristale anisotropice, care, în majoritatea cazurilor, sunt orientate dezordonat unul către celălalt. Prin urmare, proprietățile în toate direcțiile sunt mai mult sau mai puțin aceleași, adică corpul policristalin este pseudo-izotrop. O astfel de izotropie imaginară a metalului nu va fi observată prin cristalizare direcțională și deformare semnificativă la rece.