In ultimii ani, datorita progreselor in biologie moleculara si celulara a reușit să descifreze multe dintre mecanismele de patogeneza diferitelor boli, inclusiv cancerul și autoimune. În special, a fost posibil să se determine semnele fenotipului malign: sensibilitate la semnalele de creștere pentru a crește semnalele de toleranță-igibitornym, protecția împotriva morții celulare programate (apoptoza), potențialul replicativ nelimitat, angiogeneza, invazia tisulară și a metastazelor. Apariția acestor date a fost un impuls pentru a căuta în mod fundamental noi metode de terapie, punct, cu scopul de a acționa pe părți cheie ale lanțului patogenic al procesului patologic, a primit în legătură cu denumirea comună de „terapie vizate“.
Utilizarea anticorpilor monoclonali ca agenți terapeutici a fost o etapă strategică pentru medicamente în schimbarea conceptului de tratament - de la terapia nespecifică la cea specifică (țintită). Dezvoltarea anticorpilor monoclonali vizează identificarea și interacțiunea agenților care rezultă cu ținte celulare specifice sau căi de semnalizare, care în cele din urmă conduc la moartea celulară prin diferite mecanisme. Anticorpii monoclonali, spre deosebire de medicamentele tradiționale, sunt foarte specifici pentru obiective specifice. Până în prezent, acestea sunt utilizate cel mai activ în oncohematologia și tratamentul tumorilor solide și a bolilor autoimune. Anterior, accentul a fost pus pe acțiunea citolitice a anticorpilor monoclonali prin stimularea răspunsului imunitar. Recent, accentul principal se pune pe țintele-cheie implicate în reglementarea creșterii celulelor tumorale și furnizarea vizată de agenți citotoxici. S-a demonstrat acum că anticorpii terapeutici utilizați în plus față de acțiunea directă efectuează funcții efectoare imuno-mediate, incluzând citotoxicitatea dependentă de anticorp și dependentă de complement.
Astfel, anticorpii monoclonali pot promova activarea unui răspuns imun tumoral.
În prezent, FDA a aprobat utilizarea unui număr de medicamente care conțin anticorpi monoclonali (Tabelul 1). Companiile farmaceutice desfășoară în mod activ studii clinice pentru a extinde indicațiile pentru utilizarea medicamentelor aprobate.
Anticorpi monoclonali autorizați de FDA
Receptorul glicoproteinei IIb / IIIa
Sindromul coronarian acut
Factorul de necroză tumorală-a
Afecțiuni inflamatorii (în principal, autoimune)
Leucemie limfocitară cronică
Receptori IL-2 a
Factor de creștere endotelial vascular
Receptorul factorului de creștere epidermic
Receptori IL-2 a
Sistemul complementului C5
Afecțiuni inflamatorii, incluzând hemoglobinuria paroxistică
Receptor CD11a adeziv
Afecțiuni inflamatorii (psoriazis)
Limfomul non-Hodgkin (cu ibrium-90 sau indiu-111)
Factorul de necroză tumorală-a
Afecțiuni inflamatorii (în principal, autoimune)
Receptorul VLA4 adeziv
Bolile imuno-inflamatorii (în principal, autoimune și, în primul rând, scleroza multiplă)
Imunoglobulina E (IgE)
Boli imuno-inflamatorii (în principal, astm)
Protein epitop f RSV
Infecția virală (virusul sincițial respirator (RSV)
Receptorul factorului de creștere epidermic
Factor de creștere endotelial vascular
Receptorul factorului de creștere epidermic
Cancerul de sân
Cu toate acestea, în cazul în care utilizarea Rituximab (Rituxan / MabThera) pentru tratamentul neoplaziei cu celule B a fost confirmată nu numai eficiența, dar, de asemenea, securitatea, meta-analiza a utilizării inhibitorilor de citokine și factori de creștere (ca un obiectiv-cheie) oferă o imagine mai puțin pozitivă.
Dezvoltarea unor astfel de complicații este destul de previzibilă. Celulele sistemului imunitar și alte celule somatice interacționează între ele cu o gamă largă de mediatori, în special citokine și factori de creștere. Această interacțiune are caracterul reacțiilor în cascadă și al reglementării prin tipul de feedback. Dezvoltarea procesului patologic perturbă echilibrul delicat, provocând o disreglementare a interacțiunilor intercelulare, care se manifestă sub formă de procese imuno-inflamatorii și autoimune, creșterea tumorii etc.
La un exemplu de acțiune a factorului de necroză tumorală alfa (TNFalfa) mecanisme cunoscute am încercat să formuleze cerințele pentru agenții terapeutici care blochează TNF, să evalueze și potrivire anticorpi terapeutici anti-TNF (TAT) aceste cerințe.
Primul, care implică interacțiunea dintre TNF și receptorul transmembranar TNF-R1 (p55), a fost studiat în detaliu. Fără a intra în particularitățile proprietăților structurale și funcționale ale moleculelor care interacționează, observăm că legarea TNF la receptorul TNF-R1 induce activarea acestuia din urmă. În funcție de tipul și starea celulelor, precum și de micromediul, activarea TNF-R1 conduce la realizarea uneia dintre posibilele căi de semnalizare (Figura 1).
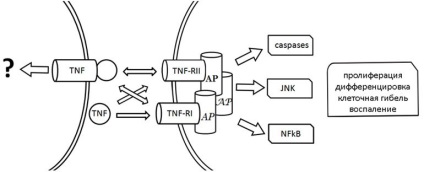
Figura 1. Schema căilor de semnalizare dependente de TNF. Receptorii TNF-RI și TNF-RII TNF, proteinele adaptorului AP
În cazul citotoxic semnalizării arătat că asocierea fizică a TNF-R1 cu proteine adaptor TRADD / FADD începe așa-numitul cascada caspazelor (activarea enzimelor proteolitice), care, în majoritatea cazurilor, terminate degradarea diferitelor ținte intracelulare, inclusiv ADN-ul nuclear si moartea celulelor. TNF-R1 interacțiunea cu alte proteine adaptor (TRAF2, RIP, NIK, FAN et al.) Poate stimula activarea diferitelor proteine intracelulare, în particular factor de transcriere NF-ĸB, kinazei JNK, caspazele, sfingomielinază și altele. La nivel celular, activarea TNF -R1 poate provoca moartea, proliferarea și diferențierea celulelor. Mai mult, sa constatat că activarea TNF-R1 morfogenetică afectează atribute cum ar fi forma și motilitatea celulelor, contactele celulă-celulă.
Interacțiunea transmebrannogo TNF și TNF-R2 (p75) este un alt tip de efecte TNF celulare afișaj (Fig. 1). Se crede că, în contrast cu TNF-R1, capabil să fie activat după legarea ambelor mTNF și rTNF, TNF-R2 activează în principal mTNF. Prin urmare, formarea complexului rTNF-TNF-R2 este considerată ca o metodă de creștere a concentrației locale rTNF pe membrana celulelor pentru transmiterea ulterioară a TNF-R1 ( «-trecere ligand») și / sau ca mijloace de blocare competitivă mTNF parțială / interacțiune și TNF-R2. Ca și în cazul TNF-R1, TNF-R2 activat pot forma asociați cu diverse proteine adaptor (TRAF1, TRAF2, RIP, FADD) și, prin urmare, să inițieze activarea diferitelor căi de semnalizare care cauzează proliferarea moartea sau celulă.
Imaginea de ansamblu a efectelor TNF celulare este complicată de lung cunoscut faptul că limfotoxină-alfa (LTalfa), alte citokine familiei TNF, capabil de a interacționa cu receptorii factorului de necroză tumorală. Astfel, TNF poate afecta funcționarea altor citochine prin reglarea legarea și activarea acestuia.
Manifestările fiziologice ale activității TNF sunt extrem de largi. Aici vom da doar câteva exemple de acțiune TNF.
În cazul blocării TNF sistemice, așa cum se face acum, de exemplu, în tratamentul bolilor autoimune, trebuie să se aștepte o scădere bruscă a concentrației de TNF solubil în sângele unui pacient și blocarea forma transmembranară a citokinei. Efectele proinflamatorii ale TNF vor fi suprimate temporar, hiperplazie dependentă de TNF de sinoviocite va fi blocată dacă există, de exemplu în artrita reumatoidă. Cu toate acestea, inhibarea proceselor inflamatorii la nivelul TNF părăsește corpul aproape la „OFF“ a sistemului imunitar, cu toate consecințele sale, în afară de bine cunoscute; suprimarea apoptozei dependente de TNF crește probabilitatea de supraviețuire și de reproducere a celulelor transformate, etc. se încheie cu o creștere în greutate a pacientului si somnolenta permanenta.
Astfel, terapia anti-TNF TAT utilizată nu îndeplinește criteriile (vezi mai sus). Blocând una dintre legăturile "cheie" în procesul patologic, efectul dorit se realizează cel mai bine temporar, deoarece sunt incluși factori auxiliari "non-cheie" și în contextul reacțiilor grave nedorite. Prin urmare, terapia cu anticorpi monoclonali, în ciuda atracției sale comerciale, în opinia noastră, nu este o direcție promițătoare pentru tratamentul pe termen lung. Evident, dezvoltatorii de noi medicamente înțeleg acest lucru.
Protocoalele moderne se bazează pe o abordare combinată la tratament, inclusiv vaccinuri, chimioterapie, anticorpi monoclonali. Această abordare se bazează pe presupusa sinergie terapeutică. În plus, posibilitatea utilizării liganzilor peptide recombinante conjugate cu citotoxine penetrante în interiorul celulelor, inhibitori ai moleculei mici care pot acționa asupra receptorilor intracelulari și întrerupă procesul de transducție a semnalului de domeniu, ARN mic (IPNA). Identificarea celulelor stem în diferite tipuri de tumori deschide noi ținte responsabile pentru progresia și metastazele lor.
Astfel, numai o abordare integrată care ia în considerare legăturile patogenetice diferite și diferitele clase de medicamente poate asigura efectul necesar cu un risc minim pentru pacient.