1) Originea și semnificația termenului "Synergetics".
Termenul de sinergie a fost propus de G. Haken. Acest nume provine de la synergeia greacă, ceea ce înseamnă o acțiune cooperativă sau de cooperare.
Synergetics este efectul colectiv cumulativ al interacțiunii unui număr mare de subsisteme, care conduce la formarea de structuri stabile, adică auto-organizare în sisteme complexe.
Obiectul principal al studierii sinergiei este structurile disipative. Ie structuri care pot exista doar în prezența schimbului intensiv cu mediul. Ie aceste structuri trăiesc în detrimentul mediului lor. Acestea sunt structuri dinamice.
2) Diferența dintre abordările din cibernetică și sinergie.
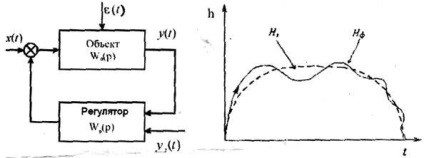
Dacă Cibernetică se concentrează pe rolul direcției (autoritatea de reglementare), sinergia sarcina principală este de a alege astfel de efecte asupra sistemului, ceea ce ar fi în concordanță cu proprietățile sale interne. Scopul principal al sistemului de control cibernetic este de a stabiliza sistemul cu privire la un nivel sau modul de program predeterminat, în sarcină principală sinergie este de a stabili condițiile tranziției sistemului într-o stare instabilă, ceea ce permite de a aduce sistemul la un nivel structural superior.
3) Care este structura disipativă.
Structura disipativă - o structură care se schimbă cu substanța sau cu energia mediului. Un exemplu este schimbul de căldură, expansiunea gazului împrăștiind picături de cerneală în apă, nori, celule binare, populații de animale.
4) Ce este un fractal?
Termenul fractal provine din cuvântul grecesc "fractus" - rupt, disecat, fracționar. Ea este formată printr-o repetare infinită a formulei originale într-o scară în continuă scădere, conform unei anumite legi, adică este o structură spontană. Structurile fractale joacă un rol important în studierea problemei trecerii de la ordine la haos și invers.
5) Principiul ordinii lui Boltzmann.
Boltzmann a încercat să descrie probabilitatea ca sistemele să conțină un număr mare de particule.
Din principiul lui Boltzmann rezultă că o modificare termodinamică ireversibilă este o aproximare față de stările mai probabile și că atractorul de stat este o stare macroscopică care corespunde maximului de probabilitate. Odată ce această stare este atinsă, sistemul se abate de la ea doar pentru o mică distanță și pentru o perioadă scurtă de timp. Ie sistemul fluctuează aproape de starea atractorului. Entropia în echilibru = 1 maximă.
6) Două principii ale asimetriei naturii pe exemple de conversie a energiei.
Asimetria internă este unidirecționalitatea tuturor proceselor spontane apărute în natură. Corpurile calde se răcesc în timp, dar cele reci nu devin fierbinți de la sine, mingea bouncing se oprește treptat, dar mingea nu urcă spontan.
Un alt aspect al asimetriei naturii îl reprezintă transformarea căldurii în muncă. Acest aspect al naturii nu ne permite pur și simplu pune stăpânire energia stocată în combustibil, dar, de asemenea, pentru a extrage din ea forța motrice, CT, la rândul său, face posibilă ridicarea de structuri artificiale, vehicule comunica la distanță.
7) Relația reciprocă Onsager (legătura dintre forțe și fluxuri în termodinamica liniară).
Această relație determină regiunea termodinamicii liniare.
În cazul în care sistemul poate fi descris prin aceste ecuații liniare și există relație mutuală între aceste procese constă în aceea că forța (1) acționează asupra fluxului (2), în același raport ca putere (2) la debitul (1), sistemul este liniar .
8) Teoria producției minime a entropiei și concluziile derivate din ea.
Evoluția într-un sistem deschis este posibilă dacă dS = ∫dS<0, то в системе возможно
formarea unei structuri ordonate și într-o stare staționară.
dS = 0 și de S = -di S. Dacă di S și de S -> 0, atunci sistemul tinde spre echilibru termodinamic, adică la haosul maxim. Srav = Smax. Următoarele trei ecuații sunt folosite pentru a obține ecuația:
1) Ecuația balanței de masă:
2) Raport diferențial Gibbs:
3) Ecuația echilibrului entropiei:
- departe de starea staționară.
- în stare staționară.
Într-un sistem liniar, perturbațiile (fluctuațiile) care au apărut în interiorul sistemului sau introduse extern sunt asimptotic amortizate.
Prin urmare, autoorganizarea, în sensul formării spontane a unei noi structuri mai organizate, este imposibilă.
Sistemul de echilibru actual poate fi calculat prin același potențial termodinamic ca și pentru termodinamica de echilibru. Astfel de sisteme sunt descrise matematic și previzibile.
9) Criteriul evoluției.
, unde - destabilizarea (chimismul), - stabilizarea (difuzia).
În domeniul liniar devine teorema minimă de producție a entropiei.
10) Relația dintre condițiile de stabilitate termodinamică și cinetica reacțiilor chimice.
11) Mecanism simplificat pentru formarea celulelor hexaedrice în modelul Benard.
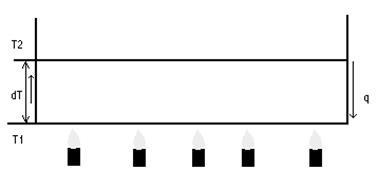
2) ΔT = ΔT este instabilitatea convectivă critică. Celulele Benard apar.
3) creșterea în continuare conduce la turbulențe.
12) Exemple de rezolvare a problemelor neliniare de conducere a căldurii și aplicarea lor practică.
Distribuția căldurii în cilindru:
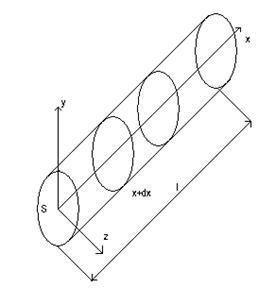
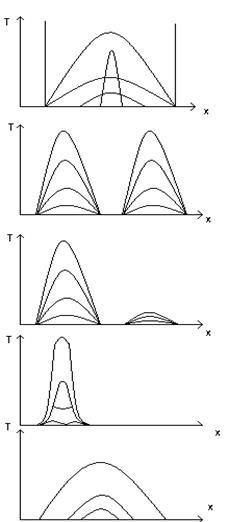
Căldura ajunge în punctele A și B și se oprește
Dacă cele două surse sunt departe, ele se vor dezvolta independent una de cealaltă.
Dacă două surse sunt aproape, atunci unul se suprimă celuilalt
În funcție de parametrii inițiale, se poate obține modul dorit de propagare a undelor termice.
13) Componentele entropiei în reacția de oxidare a fierului.
1) entropia în mediul înconjurător;
2) entropia datorită reducerii volumului;
14) Componentele entropiei în reacția de disociere.
1) ca urmare a entropiei
2) entropia datorată comenzii mișcării termice a moleculelor.
3) entropia datorată numărului de particule
4) entropia de amestecare are un maxim.
15) Ce știi despre reacția lui Belousov-Zhabotinsky.
Reacția Belousov-Zhabotinsky este un exemplu de reacție autocatalitică. Reacția constă în oxidarea unui acid organic în prezența unui catalizator adecvat, a ceriului sau a manganului. Vizualizată vizual în alternanța benzilor roșii și albastre printr-un timp strict definit. Acest lucru se numește un ceas chimic.
Ca punct de fierbere de zgură și omogenizării scade sale de suprafață pentru nucleația de bule în stratul podshlakovom (fierbere suprafață terminată). Pentru suficient de metal intensiv de tranziție în straturile inferioare și asigură nucleația și creșterea de bule pe vatra trebuie să crească gradientul concentrației de oxigen în metal în ceea ce privește echilibrul și gradientul concentrației de oxigen în zgură relativ la echilibrul dintre zgură și metal.
17) Schema mecanismului de oscilație în oscilatorul metalurgic-oscilator.
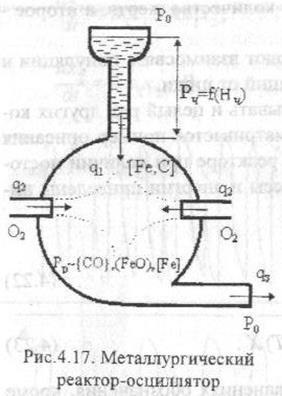
18) Principiul celui mai puțin compulsiv.
Atunci când un impact extern asupra sistemului, ca răspuns, sistemul generează acțiune vizează combaterea influenței externe. Dovada folosește ecuația.
19) Principiul subordonării.
Etapa cea mai simplă de evoluție:
Dacă substanța 1 cu concentrația q1 se formează autocatalitic din substanța 2 cu concentrația q2, atunci ecuația de evoluție pentru viteza de formare a substanței 1 are forma
Reacțiile autocatalitice care apar în anumite condiții obligatorii prezintă anumite proprietăți ale sistemelor vii:
metabolismul - utilizarea constantă a materiilor prime pentru crearea de compuși chimici noi;
auto-producție - capacitatea materiei, înmulțirea cu materii prime;
selecție (selecție) - comportamentul concurențial al componentei în constrângerile ceaiului LES impuse materiei prime sau numărul total de locuri disponibile (concentrațiile) în cele din urmă rămâne componenta care este cel mai potrivit.
20) Exemple de micro oscilatoare în metalurgie.
21) Raporturile pentru dimensiunea critică a regiunii de difuzie.
22) Abaterea de la echilibru și bifurcare (diagramă de bifurcare).
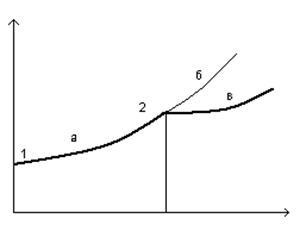
a) Stările staționare apropiate de echilibru sunt asimptotic stabile
b) După o anumită valoare critică, ramura termodinamică poate deveni instabilă și chiar o perturbație suficient de mică conduce sistemul din ramura termodinamică.
c) noul regim stabil poate corespunde stării ordonate
2 - punctul de bifurcare.
23) Rolul fluctuațiilor în mecanismul de auto-organizare.
Apariția unei instabilități poate fi privită ca rezultat al unei fluctuații care a fost localizată într-o mică parte a sistemului și apoi răspândită și condusă într-o nouă stare macroscopică, adică Influența fluctuațiilor asupra sistemului poate duce la ordonarea (autoorganizarea).
24) ecuația dinamicii populațiilor de animale datorită resurselor comune.
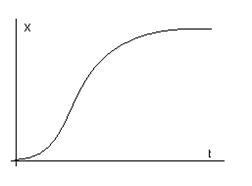
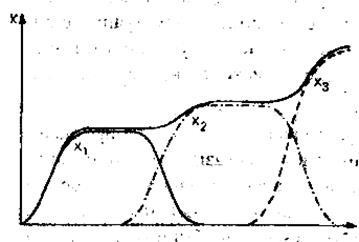
25) Ecuațiile populațiilor de tip prădător-pradă.
X - sursa de alimentare, Y - prădător
26) Derivarea ecuației Langevin.
27) Derivarea criteriului de evoluție cu o ieșire la conectarea stabilității cu parametrii termodinamici.