1. Compoziția atomului. Modelul structurii atomului.
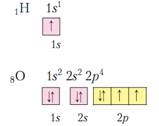
2. Starea electronilor într-un atom.
3. Structura cojilor de electroni de la atomi 1-4 perioade.
4. Dependența proprietăților elementelor de configurația electronică. Electronegativitate. Proprietăți metalice și nemetalice.
5. Conceptul de legătură chimică. Tipuri de conexiuni: covalent, ionic, metalic. Polaritatea comunicării. Valence. Formule structurale.
6. Latte cristaline. Dependența proprietăților substanțelor de tipul rețelei de cristal.
7. Gradul de oxidare. Procesele de oxidare-reducere.
Atomul este cea mai mică particulă chimică indivizibilă, dar această particulă are o structură complexă. În 1911, Rutherford a propus un model planetar al structurii atomului. Puțin mai târziu - în 1913 a apărut teoria lui Bohr. Esența teoriilor lor este după cum urmează:
În centrul atomului există un nucleu pozitiv care ocupă o parte nesemnificativă din spațiul atomului. În jurul nucleului electronii se mișcă, formează așa-numitul. cochilie electronică. Încărcarea lor totală este egală cu sarcina nucleului atomului, dar cu semnul opus. Atomul este o particulă neutră din punct de vedere electric.
Nucleul unui atom constă din protoni și neutroni, uneori numiți nucleoni. Diferite tipuri de atomi cu numere diferite de protoni și neutroni se numesc nuclide. Nucleul concentrează aproape întreaga masă a atomului. Masa protonului este de 1 amu. masa neutronului 1 amu masa electronilor = 1/1823 amu prin urmare, masa carcasei de electroni este neglijabil mică în comparație cu masa nucleului. Numărul de protoni dintr-un atom se numește numărul de protoni ai atomului. Setul de atomi cu același număr de protoni se numește un element chimic. Numărul de proton coincide cu numărul de serie al elementului din MS. Nucleul este încărcat pozitiv; încărcarea protonului = +1, neutronul = 0, sarcina nucleului este determinată de numărul de protoni și este, de asemenea, egală cu numărul de ordine al elementului. Suma protonilor și a neutronilor se numește numărul de masă al elementului. Deoarece este suma protonilor și a neutronilor care determină masa atomului. Numărul de ordine (numărul protonilor) și numărul de masă (nucleon) sunt cele mai importante caracteristici ale atomului. Ele sunt indicate în apropierea semnului elementului chimic, de exemplu: 23 11 Na. Dacă atomii au același număr de protoni, dar un număr diferit de neutroni, acești atomi sunt numiți izotopi. Ie Na De exemplu: 12 6 C și 13 6 С. Uneori, pe de altă parte, numărul de neutroni este înregistrat din semnul elementului chimic, adică pentru 12 6 С - 12 6 С 6. și pentru 13 6 С - 13 6 С 7. Distingați izotopii stabili și radioactivi. Cunoscând fracțiunea de masă a tuturor izotopilor unui element chimic și numărul lor de masă, putem calcula masa atomică medie a elementului.
pentru că încărcarea nucleului este egală cu sarcina învelișului de electroni și pentru fiecare electron sarcina (-1), atunci numărul de protoni este egal cu numărul de electroni. Acești electroni se mișcă în anumite orbite în jurul nucleului.
Acest model al atomului este foarte clar și util. Dar imediat a fost o întrebare. Conform teoriei electromagnetice, care se mișcă într-o orbită cu accelerație, un electron trebuie să emită în mod continuu energie și astfel se va mișca într-o spirală și mai devreme sau mai târziu va cădea pe miez. În acest timp, sa demonstrat discreența energiei electrice. De aceea, Bohr a prezentat ipoteza că în timp ce se deplasează de-a lungul orbitei, electronul nu emite energie, acest lucru se întâmplă numai atunci când trece de la o orbitală la alta.
Modern TSA a apărut ca urmare a regândirii și completării teoriilor lui Rutherford și Bohr. Cel mai important concept a fost conceptul unui nor electronic, care a înlocuit conceptul de electron ca particulă. Teoria modernă a structurii unui atom ia în considerare proprietățile undelor unui electron.
Electronul are o natură duală. Ca particulă, are o anumită masă și încărcătură, iar ca val este capacitatea de a schița un obstacol (difracție). Pentru un electron este imposibilă măsurarea exactă a coordonatelor și a energiei în același timp. El se mișcă cu o viteză foarte mare, iar caracterul mișcării sale este probabilist. Ie nu se deplasează pe o anumită traiectorie, ci haotic, în spațiul din apropierea nucleului, iar probabilitatea de a fi în diferite puncte ale acestui spațiu nu este aceeași. Acest spațiu este aproape de nucleu, unde șederea unui electron este numită cel mai probabil un nor de electroni sau un orbital electronic.
Orbitalele au o anumită dimensiune, formă și sunt situate în spațiu într-un anumit mod. Numerele cuantice sunt folosite pentru a caracteriza aceste proprietăți ale orbitalilor. Sunt doar 4 dintre ele.
Principalul număr cuantic determină dimensiunile orbitalilor și, prin urmare, distanța de la nucleu. Este de la numărul principal (dimensiunea orbitalilor) că energia electronului depinde cel mai mult. Orbitalele de aproximativ aceeași dimensiune formează un strat electronic (nivel electronic). Numărul poate avea valorile n = 1,2,3,4 ... și cu cât valoarea n este mai mare, cu atât mai mult, de obicei, energia electronului. Adesea, structura atomului este reprezentată sub forma unei diagrame:
și anume pentru sodiu (№11) +11) 2) 8) 1
Nivelurile sunt împărțite în subsoluri. Iar numărul de subsoluri posibile este egal cu numărul acestui nivel. Ie la un nivel, 1 sublevel, 2 - 2, 3 -3, și așa mai departe.
Sublevels sunt formate de orbite, aceleași nu numai în mărime, dar și în formă. Această formă de orbital este determinată de cel de-al doilea (orbital) număr cuantic. Sublevels sunt de obicei marcate cu literele:
Nivelul 2 - 2s, 2p
Nivelul 3 - 3s, 3p, 3d
Nivelul 4 - 4s, 4p, 4d, 4f ...
Cel de-al treilea număr cuantic este numit magnetic, determină orientarea orbitală în spațiu și numărul său pe subsol. Pentru s-subsub, numărul de astfel de orbite la orice nivel este 1. Pentru p-subsol, 3. Pentru d -5. Pentru f - 7 ...
Cel de-al patrulea număr orbital caracterizează eigenstatul unui electron într-un atom, care, simplist, poate fi reprezentat ca momentul rotației electronului. Poate avea doar două valori, adică (simplificată) fie una sau cealaltă. Această caracteristică a unui electron se numește spin, iar numărul se numește spin. Ie electronii care au trei numere cuantice identice trebuie să aibă valori diferite de spin.
1). Regula Klechkovsky sau principiul energiei minime, adică Într-o stare stabilă (staționară), electronii umple mai întâi orbitele cu un nivel de energie mai scăzut. Energia unui electron depinde de suma principalului și de numărul orbital cuantum, apoi, pe măsură ce crește energia, orbitele formează o serie:
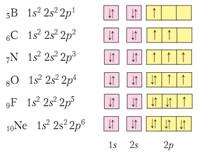
2). Principiul interzicerii lui Pauli, nu pot exista doi atomi identici în atom, adică cu același număr de 4 numere cuantice. Adică, pe o orbită nu pot exista mai mult de doi electroni, mai mult decât atât, cu spini opuși.
Orbitalele pot fi reprezentate în mod condiționat de celulele - celule. Și într-o celulă, tragem sau ↑ ↑. sau numai ↓. sau doar ↑. Dar ↑↑ este interzis de principiul Pauli.
3). Regula lui Hund. Pe un subsol, valoarea numărului de spin al electronilor trebuie să fie maximizată, ceea ce înseamnă că umplerea subsalvei de către electroni are loc mai întâi una câte una, și numai atunci are loc asocierea. - Este interzis!
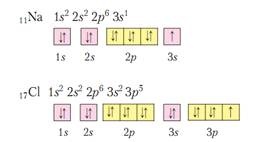
În formarea legăturilor chimice, electronii din stratul de electroni externi iau de obicei parte. Se numesc benzi de valență. În elementele subgrupurilor, d-electronii pot participa la formarea legăturilor. Numărul de electroni pe stratul exterior pentru elementele principalelor subgrupe (elementele s și p) este egal cu numărul grupului și coincide cu valența maximă și gradul maxim de oxidare a elementului.
Energia cea mai favorabilă este configurația electronică a stratului de electroni umplut - s 2 p 6 (pentru 1 strat pur și simplu s 2). (Energie favorabilă sunt, de asemenea, ocupate suprafețe sublevels și semi-umplut sublevels). Prin urmare, toate elementele tind să-și completeze stratul electronic pentru a avea această configurație. În acest scop, elementele dau fie electroni de valență, fie le atașează, îndepărtându-se de alți atomi.
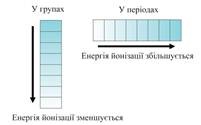

Elementele cu înaltă EO se referă la nemetale.
În perioadele de EE crește cu creșterea numărului, în subgrupuri - scade. Polling a reușit să măsoare această EA și a aranjat elementele la rând:
Cunoscând poziția elementului în PS, putem caracteriza structura și proprietățile sale electronice.
Caracteristica elementului conform PS (plan)
1) poziția în SS (număr secvență, perioadă, grup, subgrup, masa atomică)
2) compoziția atomului (numărul de protoni, neutroni, electroni)
3) distribuția electronilor peste nivele, subsoluri, orbite (diagramă de structură, formulă electronică, celule cuantice).
4) caracteristica a structurii și proprietăților elementului electronic și compușii săi (numărul de straturi de electroni, fie completat stratul de electroni exterior ca electronii asupra acestora, ceea ce elementul EO oxidare caracteristic, numărul de electroni nepereche de orbitali liberi posibil element de valența compuși elementa- caracteristice oxid și hidroxid, LAN);
Concluzie: proprietățile metalice sau nemetalice ale elementului și compararea proprietăților elementului cu vecinii săi prin perioadă și subgrup.
Numai gazele inerte în condiții standard sunt într-o stare monatomică. Toate celelalte, încercând să-și completeze stratul electronic exterior, formează legături chimice. Această dorință de a avea 8 electroni pe stratul exterior este numită regula octetului. De obicei, înainte de a intra într-o reacție chimică, atomul trebuie să primească energie suplimentară și să intre într-o stare excitată.
Legătura chimică are o natură electronică, adică se formează datorită interacțiunii dintre nuclee și electronii atomilor. Există mai multe tipuri de legături chimice.
Legătura covalentă se formează datorită perechilor electronice comune. Este caracteristică pentru metale neferoase, adică elemente cu înaltă EO.
Distingeți între legătura polară covalentă și legătura covalentă nepolară (CP și CNR). Dacă atomii care formează legătura sunt identici, atunci perechea de electroni aparține egal celor doi atomi, iar legătura este numită CNR. Dacă atomii sunt diferiți, atunci perechea de electroni este deplasată la un atom mai mult de EO, sarcini parțiale, "poli", legătura CP apare pe atomi.
Dacă elementele sunt foarte diferite în EO, adică aparțin unuia dintre metale, celălalt nemetalilor, apoi electronii se transferă complet la un atom mai mult de EO, se formează încărcări reale pe atomi. Atomii sunt transformați în ioni. Legătura dintre ioni se numește ionică.
Substanțele simple - metalele formează un tip special de legătură chimică, care se numește metal. Se realizează prin electroni de valență, care sunt în posesia comună a tuturor atomilor de metal (gaz de electroni).
O mulțime de atomi care se conectează unul cu altul formează substanțe. În stare solidă, substanțele pot avea o structură ordonată (cristalină) și dezordonată (amorfă). Modelul stării cristaline a unei substanțe se numește o latură de cristal. În funcție de tipul de particule care formează o latură de cristal și de tipul de legătură chimică, se obișnuiește să se facă distincția între o latură de cristal moleculară, ionică, atomică și metalică. Cu cât legătura dintre particule este mai puternică, cu atât este mai mare punctul de topire al substanței, duritatea este mai mare. Cu cât conexiunea este mai polară, cu atât este mai mare probabilitatea dizolvării substanței în apă.
O caracteristică importantă a elementului este gradul său de oxidare. Gradul de oxidare este o sarcină condițională. care ar putea apărea pe atom, dacă toți electronii care formează legăturile chimice au fost mutați într-un atom mai electronegativ.