Aminoacizii - componente structurale ale proteinelor Proteinele sau proteinele (protos grecesc - paramount) sunt heteropolimeri biologici ai căror monomeri sunt aminoacizi.
Aminoacizii sunt compuși organici cu greutate moleculară mică care conțin grupări carboxilice (-COOH) și amină (-NH2), care sunt legate la același atom de carbon. Un lanț lateral este atașat la atomul de carbon - un anumit radical care dă fiecărui aminoacid anumite proprietăți. Formula generală a aminoacizilor este:
Majoritatea aminoacizilor au o grupare carboxil și o grupare amino; acești aminoacizi sunt numiți neutri. Există însă aminoacizi bazici - cu mai mult de un grup amino, precum și aminoacizi acide - cu mai mult de o grupare carboxil.
Există aproximativ 200 de aminoacizi găsiți în organismele vii, dar numai 20 dintre aceștia fac parte din proteine. Acestea sunt aminoacizii așa-numiți bazici sau albe (proteinogenici).
În funcție de tipul de aminoacizi bazici radicali sunt împărțiți în trei grupe: 1) nepolari (alanină, metionină, valină, pro-Ling, leucină, izoleucină, triptofan, fenilalanină); 2) încărcare polară (asparagină, glutamină, serină, glicină, tirozină, treonină, cisteină); 3) încărcat polar (arginină, histidină, lizină - pozitivă, acid aspartic și acid glutamic - negativ).
Lanțurile laterale ale aminoacizilor (radicali) pot fi hidrofobi sau hidrofili, care dau proteinele proprietățile corespunzătoare care se manifestă în formarea structurilor proteice secundare, terțiare și cuaternare.
În plante, toți aminoacizii necesari sunt sintetizați din produsele primare de fotosinteză. Omul și animalele nu sunt în măsură să sintetizeze un număr de aminoacizi proteogeni și ar trebui să le primească în formă gata împreună cu alimentele. Astfel de aminoacizi sunt numiți de neînlocuit. Acestea includ lizina, valina, leucina, izoleucina, treonina, fenilalanina, triptofanul, metionina; precum și arginina și histidina - de neînlocuit pentru copii,
În soluție, aminoacizii pot acționa ca și acizi și baze, adică sunt compuși amfoterici. Gruparea carboxil-COOH este capabilă să renunțe la proton, funcționând ca un acid și amina-NH2 - pentru a lua protonul, prezentând astfel proprietățile bazei.
Peptidele. O grupare amino a unui aminoacid este capabilă să reacționeze cu o grupare carboxil a unui alt aminoacid.
Molecula rezultată este o dipeptidă, iar legătura -CO-NH este numită o legătură peptidică:
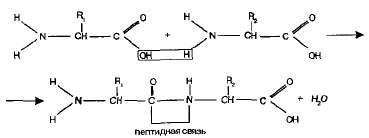
La un capăt al moleculei dipeptide este o grupare amino liberă și, pe de altă parte, o grupare carboxil liberă. Datorită acestei dipeptide se poate atașa alți aminoacizi, formând oligopeptide. Dacă se combină atât de mulți aminoacizi (mai mult de zece), atunci se obține o polipeptidă.
Peptidele joacă un rol important în organism. Multe oligo- și polipeptide sunt hormoni, antibiotice, toxine.
Oligopeptide sunt oxitocina, vasopresina, tirotropină, și bradikinina (o peptidă de durere), precum și anumite opiacee ( „medicamente naturale“ persoană), îndeplinind funcția de gestionare a durerii. Acceptarea medicamentului distruge sistemul opioid al organismului, astfel încât dependentul fără o doză de medicament în mare durere - „break-up“, care este în mod normal îndepărtat de opiacee. Unele oligopeptide includ unele antibiotice (de exemplu, gramicidina S).
Mulți hormoni (insulină, hormon adrenocorticotropic etc.), antibiotice (de exemplu gramicidina A), toxine (de exemplu toxina difterică) sunt polipeptide.
Proteinele sunt polipeptide, a căror moleculă include de la cincizeci la câțiva mii de aminoacizi cu o greutate moleculară relativă mai mare de 10000.
Structura proteinelor. Fiecare proteină într-un anumit mediu este caracterizată printr-o structură spațială specială. Când se caracterizează structura spațială (tridimensională), se disting patru niveluri de organizare a moleculelor de proteine (figura 1.1).
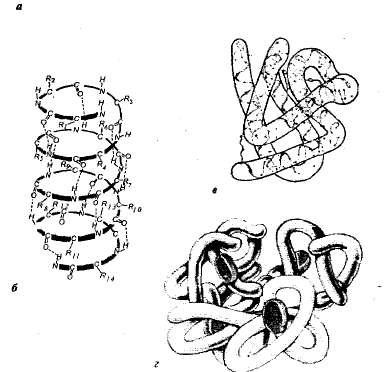
Fig. 1.1. Nivelurile organizării structurale a proteinei: a - structura primară - secvența de aminoacizi a ribonucleazei proteice (124 unități de aminoacizi); b - structura secundară - lanțul waipypeptidic este răsucite ca o spirală; c - structura terțiară a proteinei myoglobinei; d este structura cuaternară a hemoglobinei.
Structura primară este secvența aminoacizilor din lanțul polipeptidic. O astfel de structură este specifică pentru fiecare proteină și este determinată prin informații genetice, adică depinde de secvența de nucleotide din regiunea moleculei ADN care codifică proteina. Toate proprietățile și funcțiile proteinelor depind de structura primară. Înlocuirea unui singur aminoacid în compoziția moleculelor de proteine sau întreruperea ordinii în aranjamentul lor implică de obicei o modificare a funcției proteinei.
Având în vedere că compoziția proteinelor include 20 de tipuri de aminoacizi, numărul de variante ale combinațiilor lor în lanțul de polipeptide este cu adevărat nelimitat, ceea ce asigură un număr imens de tipuri de proteine în celulele vii. De exemplu, în corpul uman, au fost găsite mai mult de 10 mii de proteine diferite și toate sunt construite din aceiași 20 aminoacizi de bază.
In celulele vii, moleculele de proteine sau porțiuni specifice ale acestora nu sunt lanț extinse și răsucite într-o spirală, care seamănă cu un arc alungit (așa-numita-helix) sau îndoite într-un strat de pliat (p-strat). Astfel de helixuri și straturi p sunt o structură secundară. Ea rezultă din formarea legăturilor de hidrogen într-un lanț polipeptidic unic (o configurație spirală) sau între două lanțuri de polipeptide (straturi pliate).
O configurație complet elicoidală are o proteină cheratină. Este o proteină structurală de păr, cuie, gheare, ciocuri, pene și coarne; aceasta face parte din stratul exterior al pielii vertebratelor.
Majoritatea proteinelor și a regiunilor spirală nonspiral ale lanțurilor polipeptidice ori în formație tridimensională formă sferică - globulare (tipic pentru proteine globulare). Un globule cu o anumită configurație este o structură terțiară a proteinei. Această structură este stabilizată prin ionic, hidrogen, legături disulfidice covalente (formate între atomii de sulf sunt parte la cistitei, cistina și megionina) și interacțiunile hidrofobe. Cele mai importante în formarea structurii terțiare sunt interacțiunile hidrofobe; în care proteina încheagă, astfel încât lanțurile laterale hidrofobe sunt ascunse în interiorul moleculei, t. e. protejat de contactul cu apa, iar lanțurile laterale hidrofile, dimpotrivă, sunt expuse la exterior.
Multe proteine cu structură complicată compus din mai multe lanțuri polipeptidice (subunități), care formează structura cuaternară a moleculei de proteină. O astfel de structură există, de exemplu, în proteina globulară a hemoglobinei. molecula este format din patru subunități polipeptidice individuale (protomers) localizate în structura terțiară și o parte non-proteină - hem.
Numai în această structură, hemoglobina este capabilă să-și îndeplinească funcția de transport.
Sub influența diferiților factori fizici și chimici (tratament cu alcool, acetonă, acizi, baze, căldură, iradiere, de înaltă presiune, și așa mai departe. D.) O schimbare în structura proteinelor secundară, terțiară și cuaternară datorită ruperii legăturilor de hidrogen și legături ionice. Procesul de încălcare a structurii native (naturale) a proteinei se numește denaturare. Astfel, o scădere a solubilității proteinei, schimbarea formei și dimensiunii moleculelor, pierderea activității enzimatice și așa mai departe. Procesul de Denaturare G. poate fi completă sau parțială. În unele cazuri, trecerea la condiții normale de mediu este însoțită de o restaurare spontană a structurii naturale a proteinei. Acest proces se numește renaturare.
Proteine simple și complexe. Prin compoziția chimică, proteinele sunt simple și complexe. La prostată sunt proteine care constau numai din aminoacizi și proteine complexe - proteine care conțin parte proteică și nonproteină (protetică); grupare prostetică pot forma ioni metalici, reziduuri de acid fosforic, carbohidrați, lipide, iar altele sunt proteine simple ale albuminei serice de sange, fibrina, anumite enzime (tripsina) etc. Pentru proteinele complexe sunt toate glicoproteine și proteolipidă ..; proteine complexe sunt, de exemplu, imunoglobuline (anticorpi), hemoglobină, majoritatea enzimelor etc.
Structura. Proteinele fac parte din membranele celulare și din matricea organelor celulare. Pereții vaselor de sânge, cartilajului, tendoanelor, părului, unghiilor, ghearelor în animalele superioare constau în principal din proteine.
Catalizator (enzimatic). Proteinele-enzimele catalizează evoluția tuturor reacțiilor chimice din organism. Ele asigură scindarea nutrienților din tractul digestiv, fixarea carbonului în timpul fotosintezei și așa mai departe.
Transport. Unele proteine sunt capabile să atașeze și să transporte diferite substanțe. Acizii grași din transportul de albine din sânge, globulele - ioni metalici și hormoni, hemoglobina - oxigen și dioxid de carbon. Moleculele de proteine care alcătuiesc membrana plasmatică participă la transportul de substanțe în celulă.
De protecție. Sunt realizate imunoglobulinele (anticorpii) de sânge, care asigură protecția imună a organismului. Fibrinogenul și trombina participă la coagularea sângelui și previne sângerarea.
Contractilitatea. Datorită alunecării protofibrililor de actină și myosin unul față de celălalt, apare contracția musculară, precum și contracțiile intracelulare non-musculare. Mișcarea cilia și a flagelului este asociată cu alunecarea microtubulilor, care sunt de natură proteică în natură, relativ unul față de celălalt.
De reglementare. Multi hormoni sunt bedkami sau oligopeptide (de exemplu, insulină, glucagon, [antagonist al insulinei], hormon adrenocorticotrop, și altele.).
Receptor. Unele proteine încorporate în membrana celulară își pot schimba structura sub influența mediului extern. Acesta este modul în care semnalele sunt recepționate din exterior și informațiile sunt transferate în celulă. Un exemplu este fito-crom - fotosensibil proteină vegetală reglare reacție photoperiodic și opsin - o parte din pigment rodopsinei prezente in celulele retinei.
Energie. Proteinele pot servi drept sursă de energie în celulă (după hidroliză). De obicei, proteinele sunt consumate pentru nevoile energetice în cazuri extreme, când depozitele de carbohidrați și grăsimi sunt epuizate.
Enzime (enzime). Acestea sunt proteine specifice care sunt prezente în toate organismele vii și joacă rolul de catalizatori biologici.
Reacțiile chimice într-o celulă vii au loc la o anumită temperatură, presiune normală și aciditatea corespunzătoare a mediului. În astfel de circumstanțe ar reacțiile de sinteză sau substanțe de degradare să procedeze foarte lent în celulă, dacă acestea nu sunt expuse la enzime. Enzime accelerarea reacției, fără a schimba rezultatul său global prin reducerea energiei de activare, adică. E. Atunci când este prezent necesită semnificativ mai puțină energie pentru a conferi reactivitatea moleculelor care reacționează, sau reacția are loc alt mod, cu o barieră de energie mai mic.
Toate procesele dintr-un organism viu sunt efectuate direct sau indirect cu participarea enzimelor. De exemplu, sub acțiunea constituenților componentelor alimentare (proteine, carbohidrați, lipide și altele.) Sunt scindate la compuși mai simpli, și din ele sunt apoi sintetizate nou specific acestui tip de macromolecule. Prin urmare, încălcările formării și activității enzimelor duc adesea la apariția unor boli grave.
Prin organizarea spațială, enzimele constau din mai multe sexe și lanțuri peptidice și au de obicei o structură cuaternară. În plus, enzimele pot include structuri non-proteice. Partea de proteină este numită apoenzimei și non-proteine - cofactor (dacă cationi sau anioni de substanțe anorganice, de exemplu, Zn2- Mn2 +, etc ...) Sau coenzimei (CoA) (dacă este o substanță organică cu greutate moleculară mică).
Predecesorii sau componentele multor colaboratori sunt vitamine. Astfel, acidul pantotenic - un component al coenzimei A, niacina (vitamina PP) - precursorul NAD și NADP, etc ...
Cataliza enzimatici în aceleași legi ca catalizei neenzimatice în industria chimică, dar spre deosebire de acesta este caracterizat printr-un grad neobișnuit de mare de specificitate (numai o enzimă catalizează reacția sau valabile numai pentru un singur tip de conexiune). Aceasta asigură o reglare fină a tuturor proceselor vitale (respirația, digestia, fotosinteza etc.) care au loc în celulă și în organism. De exemplu, enzima ureazei catalizează scindarea numai o singură substanță - uree (H2N-CO-NH2 + H2O -> - »2NH 3 + CO 2), fără a exercita o acțiune catalitică asupra compușilor înrudiți structural.
Pentru a înțelege mecanismul de acțiune al enzimelor cu specificitate înaltă, teoria foarte importantă a centrului activ. Potrivit acesteia, în moleculă, fiecare enzimă are una sau mai multe porțiuni în care cataliza se produce din cauza unei mai aproape (in mai multe puncte) de contact între moleculele enzimatice și substanța specifică (substrat). Site activ sau acționează un grup funcțional (de exemplu, gruparea OH a serinei), sau aminoacizi individuali. De obicei, acțiunea catalitică este necesară combinarea mai multor (o medie de la 3 până la 12), dispuse într-o ordine specifică a resturilor de aminoacizi. Centrul activ este format de asemenea cu o enzimă legată cu ioni metalici, vitamine și alți compuși de natură non-proteină - co-enzime sau cofactori. Mai mult decât atât, forma și structura chimică a site-ului activ astfel încât să poată comunica cu numai anumite substraturi din cauza lor se potrivesc perfect, (sau complementaritate. Complementaritatea), unele cu altele. Rolul altor reziduuri de aminoacizi din molecula mare a enzimei este de a furniza forma molecula corespunzătoare globulare, care este necesară pentru funcționarea eficientă a centrului activ. Mai mult, în jurul unei molecule de enzimă mare, un câmp electric puternic. Acest câmp devine posibila orientare a moleculelor substratului și achiziționarea de formă asimetrică. Acest lucru duce la o slăbire a legăturilor chimice și reacția catalizată are loc cu la cheltuielile inițiale de energie și, prin urmare, cu o viteză mult mai mare. De exemplu, catalaza, o moleculă de enzimă poate fi scindat timp de 1 min, timp de 5 Mill. Molecule de peroxid de hidrogen (H202), care are loc în timpul oxidării diferiților compuși din organism.
Unele enzime în prezența unei configurații de substrat al centrului activ suferă modificări, t. E. Enzima orientează grupurile sale funcționale, astfel încât să asigure cea mai mare activitate catalitică.
În stadiul final al reacției chimice, complexul enzimă-substrat se separă pentru a forma produse finale și o enzimă liberă. Centrul activ eliberat poate primi noi molecule ale substratului.
Rata reacțiilor enzimatice depinde de mulți factori .. Natura și concentrația de enzimă și substrat, temperatura, presiunea, aciditatea mediului, prezența inhibitorilor, etc. De exemplu, la temperaturi apropiate de zero, viteza reacțiilor biochimice incetineste la un nivel minim. Această proprietate este utilizată pe scară largă în diverse ramuri ale economiei naționale, în special în agricultură și medicină. În special, conservarea diferitelor organe (rinichi, inima, splina, ficatul) înainte de transferul lor către pacient are loc în timpul răcirii, în scopul de a reduce intensitatea reacțiilor biochimice și prelungirea duratei de viață a corpurilor. congelare rapidă a produselor alimentare împiedică creșterea și reproducerea microorganismelor (bacterii, ciuperci, etc.), Atakzhe enzime digestive le inactivează, astfel încât acestea nu mai sunt capabile să provoace descompunerea alimentelor.
Referințe
NA Lemez L.V. Kamlyuk N.D. Lisov "Manual de Biologie pentru Admiterea în Universități"