Știți deja o mulțime de definiții ale acizilor ca o clasă de substanțe complexe.
Acizii sunt substanțe complexe, care constau din atomi de hidrogen, capabili să fie înlocuiți cu un metal și un reziduu acid.
În lumina teoriei disocierii electrolitice, acizii includ electroliți, care, atunci când sunt disociați, formează cationi ai unui singur ion de hidrogen hidratat de tip.
Teoria disocierii electrolitice explică proprietățile acido-bazice ale soluțiilor apoase de electroliți prin prezența unui exces de ioni în ele.
În plus, sunt cunoscute reacțiile în care substanțele reacționează ca acid și bază în absența ionilor de hidrogen și a ionilor de hidroxid. Rețineți, de exemplu, formarea de clorură de amoniu în interacțiunea dintre acid clorhidric gazos și amoniac. cunoscut ca fum fără foc.
In 1923 a existat teoria Protolytic a acizilor și bazelor-Johannes Laur Nicolaus Bronsted și care a extins noțiunile de acizi și baze, pentru a explica comportamentul substanțelor în soluții apoase și neapoase (alcool, eter, ammiachiyh). Conform acestei teorii, acizii sunt molecule sau ioni care sunt în donatorii de reacție ai cationilor hidrogen H + adică le dau.
În consecință, visele sunt molecule sau ioni care iau cationi H +, adică sunt acceptori H +.
Din punctul de vedere al acestei teorii, descompunerea electrolitului în ioni (I) și hidroliza prin anion (2) este considerată ca interacțiunea acid-bază a electroliților și a apei.
În reacția (1), H20 se comportă ca o bază - conectează protonul (H +) și formează ionul de oxoniu prin mecanismul donor-acceptor.
Acum, că sunteți familiarizat cu o viziune mai largă asupra irnrodu proprietăți acide ale compușilor chimici, pentru a generaliza informații despre clasă acidă, considerat clasificarea și proprietățile acizilor anorganici și organici (tab. 17).
Proprietățile acizilor
gust acru, efect asupra indicatorilor, conductivitate electrică, interacțiunea cu metale, oxizi de bază și amfoteri, baze și săruri, formarea de esteri cu alcooli - aceste proprietăți sunt comune pentru acizi anorganici și organici.
1. în apă, acizii se disociază în cationi de hidrogen și anioni ai resturilor acide, de exemplu:

Soluțiile acide schimbă culoarea indicatorilor: litmus - în roșu, portocaliu metil - în fenolftaleină roz nu se schimbă.
2. Soluțiile acide reacționează cu metalele. în seria electrochimică a solicitărilor din stânga hidrogenului, în mai multe condiții, dintre care cea mai importantă este formarea unei săruri solubile ca urmare a reacției.
3. Acizii anorganici și organici interacționează cu oxizi de bază și amfoterici, cu condiția să se formeze săruri solubile.
4. Ambii acești acizi reacționează cu baze. Acidii polibazici pot forma atât săruri medii, cât și săruri acide (acestea sunt reacții de neutralizare)
5. Reacția dintre acizi și săruri apare numai dacă se formează un precipitat sau un gaz.
6. Esterii formează nu numai acizi organici conform ecuației generale.
O reacție similară cu ushetiem două sau trei grupe hidroxi ale celulozei cu rezultatele nitrare într-un zfirov complex: Li- și trinitrotsellyulozy - foarte substanțe necesare pentru producerea prafului de pușcă fără fum.
În același timp, unii reprezentanți ai acizilor minerali și organici au proprietăți speciale.
Acidul acetic CH3COOH, ca și alți acizi carboxilici, conține un radical hidrocarbonat în moleculă. Reacțiile de substituție a hidrogenului cu halogeni sunt posibile în el:
Sub influența atomilor de halogen în molecula de acid, gradul său de disociere crește foarte mult. De exemplu, acidul cloracetic este de aproape 100 de ori mai puternic decât oțetul (de ce?).
Acid formic HCOOH. în absența oțetului, nu are un radical de hidrocarbură în moleculă. În schimb, acesta conține un atom de hidrogen și, prin urmare, este o substanță cu o funcție dublă - acidul aldehidic și. spre deosebire de alți acizi carboxilici, dă o reacție "oglindă de argint". Acidul carbonic rezultat H2C03 se descompune în apă și dioxid de carbon.
1. Cum influențează natura acidului gradul de disociere electrolitică? Luați în considerare acest efect asupra exemplelor: a) Acizi azotați și azotați, b) HClO hipoclor și clor HCI04. d) acizi sulfurici și sulfurici. Faceți o concluzie generală.
2. Luați în considerare influența reciprocă a atomilor în molecula de acid propionic CH3-CH2-COOH în conformitate cu planul: a) efectul radicalului asupra carboxilului; b) efectul carboxilului asupra radicalului; c) efectul carbonului asupra hidrocarbonului; d) efectul hidroxilului pe carbonil.
3. Aranjați acidul acrilic clorurat în ordinea cresterii rezistenței. Explicați răspunsul.
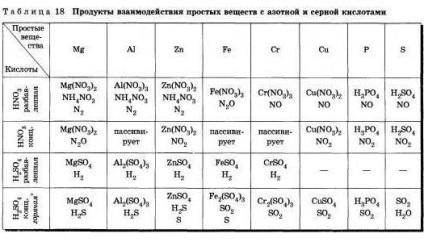
4. Atitudinea de azot și acid sulfuric (conc.) Acide se comportă diferit în reacțiile cu metalele decât, de exemplu, acidul clorhidric?
8. La 730 g de acid clorhidric 12% s-au dizolvat 33 boli de acid clorhidric. Găsiți fracția de masă a clorului în soluția rezultată.
Răspuns: 18,14%.
9. La 820 g soluție 0,5% de acid sulfuric, s-au dizolvat alte 11,2 l de dioxid de sulf. Care a fost fracția de masă a acidului în soluția rezultată?
Răspuns: 5,29%.
Dacă aveți corecții sau sugestii pentru această lecție, scrieți-ne.
Dacă doriți să vedeți alte ajustări și dorințe pentru lecții, consultați aici - Forumul educațional.